题目内容
下列说法正确的是
A.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
B.熔融的NaHS04中阴、阳离子的数目比为1:2
C.等物质的量的LiH、LiD、LiT三种物质的质子数之比为4:5:6
D.3 g乙酸分子中含有的共用电子对数是0.4NA
D
解析试题分析:A、.Ca2+、K+、Cl-、S2-是电子层结构相同的离子,核电荷数越小,半径越大,错误;B、熔融的NaHS04阴、阳离子是Na+和H S04-,数目比为1:1,错误;C、H、D、T质子数都为1, LiH、LiD、LiT的质子数之比为1:1:1,错误;D、1 mol 乙酸分子中含有的共用电子对数8NA,3 g乙酸为0.05 mol, 共用电子对数是0.4NA,正确。
考点:考查离子半径、熔融的NaHS04的电离、同位素和共价键数等相关知识。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列离子组一定能大量共存的是 ( )
| A.能使甲基橙变红的溶液中:Na+、NH4+、I-、NO3- |
| B.含有0.1 mol·L-1Ba2+ 的溶液中:K+、Mg2+、CO32-、SO42- |
| C.由水电离出来的c(H+) = 1×10-13 mol·L-1的溶液中:K+、CH3COO-、Cl-、NO3- |
| D.常温下,KW/ c(OH-)="0.1" mol·L-1的溶液:Na+、SO42-、NH4+、NO3- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0mol·L-1NaClO溶液中:Fe2+、K+、I-、Cl- |
| B.加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH+ 4 |
| C.由水电离出的c(OH-)=1×10-12mol·L-1的溶液中:NH+ 4、HCO- 3、Na+、Cl- |
| D.c(H+)/c(OH-)=1×10-14的溶液中:K+、Na+、Cl-、SiO2- 3 |
下列化学反应的离子方程式不正确的是
A.Na2S溶液中加入少量FeCl3溶液:2Fe3++S2- 2Fe2++S↓ 2Fe2++S↓ |
| B.向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应: Ca2++2OH-+2HCO3-  CaCO3↓+2H2O+CO32- CaCO3↓+2H2O+CO32- |
C.向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O SO42-+Cl-+2H+ SO42-+Cl-+2H+ |
D.Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: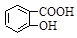 +CO32- +CO32- 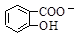 +HCO3- +HCO3- |
下列离子方程式正确的是
| A.在碳酸氢钙溶液中加入少量盐酸:Ca2++2HCO3-+2H+→CO2↑+2H2O+CaCO3↓ |
| B.硫酸铁溶液与氢氧化钡溶液:Fe3++SO42-+Ba2++3OH-→Fe(OH)3↓+BaSO4↓ |
| C.次氯酸钙溶液中通入足量二氧化硫:Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ |
| D.氢氧化钠溶液中通入过量二氧化碳:OH-+CO2→HCO3- |
下列表示对应化学反应的离子方程式正确的是
| A.NO2通入水中:3NO2+H2O=2H++2NO—3+NO |
B.用两个铜电极电解CuSO4溶液: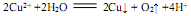 |
| C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO2—4+Fe2++4H+ |
D.过量的CO2通入NaAlO2溶液中: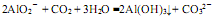 |
某中性含 Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是
| A.NH4+、Br-、CO32- | B.NH4+、I-、SO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、CO32-、I- |
下列表示对应化学反应的离子方程式正确的是
| A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O |
| B.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |
| C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O |
| D.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O |
