题目内容
绿矾(FeSO4·7H2O)、硫酸亚铁铵〔FeSO4·(NH4)2SO4·6H2O〕是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
图Ⅰ
图Ⅱ
请回答下列问题:
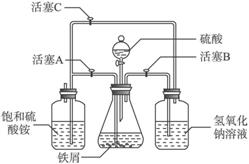
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是___________,集气瓶的作用是______________;烧杯中主要发生:①CuSO4+H2S![]() CuS↓+H2SO4
CuS↓+H2SO4
②4CuSO4+PH3+4H2O![]() H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0—
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,可制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级—Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制_________过量为最佳。
(1)铁屑、稀硫酸 安全瓶作用,防止烧杯中的洗液倒吸至锥形瓶中污染产物
CuSO4溶液 吸收H2S、PH3等尾气
(2)BC A BC(或B) A
(3)铁
解析:(1)制备FeSO4·7H2O使用铁屑和稀硫酸,集气瓶是起到安全瓶的作用,防止倒吸,由题给信息知烧杯中盛放的试剂是CuSO4溶液,目的是吸收杂质气体H2S、PH3等尾气。
(2)注意首先生成FeSO4而后将FeSO4再压入饱和(NH4)2SO4溶液中,从而确定活塞的开关。
(3)Fe2+非常容易被空气中的O2氧化为Fe3+,所以控制Fe过量时,Fe+2Fe3+![]() 3Fe2+。
3Fe2+。

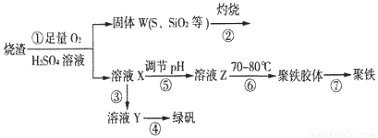
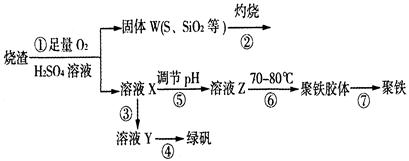
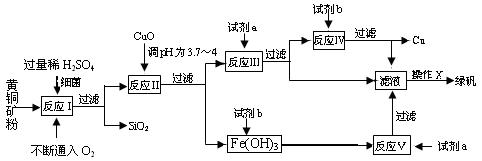
(10分) 以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
已知:①4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表:
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
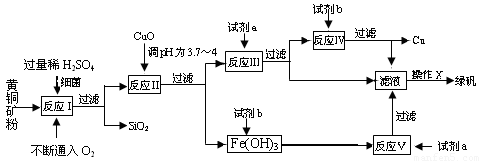
(1)试剂a是___________,试剂b是_____________。
(2)操作X应为蒸发浓缩、________________、________________。
(3)反应Ⅱ中加CuO调pH为3.7~4的目的是
。
(4)反应Ⅴ的离子方程式为___________________________。

 H如下表:
H如下表:
 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)