题目内容
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1则a为 。
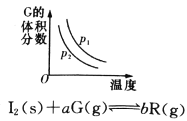
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A.0.6~0.7 B.1~1.1 C.1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。

(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。

【答案】(1)+72.49(2分)
(2)①A(2分)②氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本(2分)
(3)①1∶1(2分)②5(±0.2)%(2分)(4)N2+6e—+8H+=2NH4+(2分)
【解析】
试题分析:(1)根据盖斯定律,方程式③=②+①,反应热也进行相应运算,求得a为+72.49;
(2)①水碳比的数值在 0.6~0.7 范围进转化率提升更快,答案选A;②由图像分析可以看出,氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本,不符合经济效益。
(3)①烟气中V(NO)∶V(NO2)=5∶1,假设NO为5mol,那么NO2为1 mo,根据NO+NO2+H2O=2HNO2 这个反应,只有两者物质的量相同时才能完全被吸收,这时需要O2,根据2NO+ O2=2NO2,可知应该有2molNO参加反应生成2mol NO2,这个过程需要O21 mol,而空气中氧气的体积含量大约为20%,要提供O21 mol需要空气物质的量为5mol,所以V(NO)∶V(空气)=1∶1;②由图像可以看出当尿素浓度在5左右时转化率已经比较高了,如果浓度再增大时转化率提高不明显,所以答案填5(±0.2)%都算正确。
(4)根据氧化还原反应原理,由于N2、H2为电极反应物,正极反应元素化合价应该降低,得到电子,首先确定N2参与正极反应,再根据电解质溶液情况产物应该为NH4+,从电子守恒和电荷守恒及原子个数守恒三个角度可以确定其电极反应式为N2+6e—+8H+=2NH4+。