题目内容
【题目】已知合金A由两种常见金属组成.为测定其组成,某同学的实验流程如图所示: 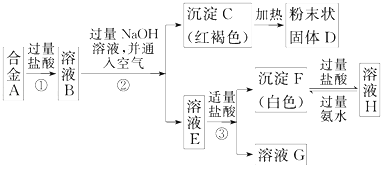
请回答:
(1)过程②中分离C和E的化学实验基本操作是;
(2)溶液H中所含的阳离子有(用离子符号表示);
(3)合金A与D在高温下反应的化学方程式 .
【答案】
(1)过滤
(2)Al3+ , H+
(3)2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
【解析】解:已知合金A由两种常见金属组成,加入过量盐酸反应得到溶液B,加入过量氢氧化钠溶液丙通入空气,过滤得到红褐色沉淀,判断为Fe(OH)3 , 加热分解得到粉末状固体D为氧化铁,则确定原来金属有Fe,滤液E加入少量盐酸生成白色沉淀F和溶液G,白色沉淀F加入过量盐酸溶解得到溶液H,溶液H加入过量氨水又生成白色沉淀F,确定白色沉淀F为氢氧化铝沉淀,溶液H为过量盐酸和AlCl3溶液,溶液G为偏铝酸钠和氯化钠的混合溶液,溶液E为NaAlO2溶液,溶液B为氯化亚铁和氯化铝的混合溶液,金属为Fe,Al,(1)过程②中分离C红褐色沉淀和E为NaAlO2溶液的化学实验基本操作是过滤,所以答案是:过滤;(2)H溶液为过量盐酸和AlCl3溶液,溶液中所含的阳离子有Al3+ , H+ , 所以答案是:Al3+ , H+;(3)D为氧化铁,Fe2O3与合金中的一种金属粉末均匀混合,在高温下反应可生成铁,反应的化学方程式为:2Al+Fe2O3 ![]() Al2O3+2Fe, 所以答案是:2Al+Fe2O3
Al2O3+2Fe, 所以答案是:2Al+Fe2O3 ![]() Al2O3+2Fe.
Al2O3+2Fe.

练习册系列答案
相关题目