题目内容
下列溶液中有关物质的量浓度关系正确的是( )
分析:A、溶液等体积混合反应后醋酸是弱电解质又电离出醋酸根离子和氢离子,溶液呈酸性;
B、NH4HSO4溶液中滴加等物质的量的NaOH反应生成硫酸钠、硫酸铵和水,形成的溶液铵根离子水解呈酸性;
C、依据碳酸氢钠溶液中电荷守恒和物料守恒计算得到;
D、依据水解的离子对水的电离起到促进作用;对应酸越弱水解程度越大;
B、NH4HSO4溶液中滴加等物质的量的NaOH反应生成硫酸钠、硫酸铵和水,形成的溶液铵根离子水解呈酸性;
C、依据碳酸氢钠溶液中电荷守恒和物料守恒计算得到;
D、依据水解的离子对水的电离起到促进作用;对应酸越弱水解程度越大;
解答:解:A、溶液等体积混合反应后醋酸是弱电解质又电离出醋酸根离子和氢离子,溶液呈酸性;pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A错误;
B、NH4HSO4溶液中滴加等物质的量的NaOH反应生成硫酸钠、硫酸铵和水,形成的溶液铵根离子水解呈酸性;向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);故B正确;
C、NaHCO3溶液中电荷守恒为:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-):物料守恒得到:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);两式计算得到:c(OH-)-c(H+)=c(H2CO3)-c(CO32-);故C正确;
D、在浓度均为0.1 mol?L-1Na2CO3、NaHCO3、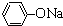 、NH4Cl溶液中,碳酸钠水解呈碱性,碳酸氢钠水解呈碱性,苯酚钠水解呈碱性;氯化铵水解呈酸性;碳酸钠溶液水解程度大于苯酚钠,苯酚钠水解程度大于碳酸氢钠,c(H+)分别为c1、c2、c3、c4,则c4>c2>c3>c1;故D错误;
、NH4Cl溶液中,碳酸钠水解呈碱性,碳酸氢钠水解呈碱性,苯酚钠水解呈碱性;氯化铵水解呈酸性;碳酸钠溶液水解程度大于苯酚钠,苯酚钠水解程度大于碳酸氢钠,c(H+)分别为c1、c2、c3、c4,则c4>c2>c3>c1;故D错误;
故选BC.
B、NH4HSO4溶液中滴加等物质的量的NaOH反应生成硫酸钠、硫酸铵和水,形成的溶液铵根离子水解呈酸性;向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);故B正确;
C、NaHCO3溶液中电荷守恒为:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-):物料守恒得到:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);两式计算得到:c(OH-)-c(H+)=c(H2CO3)-c(CO32-);故C正确;
D、在浓度均为0.1 mol?L-1Na2CO3、NaHCO3、
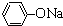 、NH4Cl溶液中,碳酸钠水解呈碱性,碳酸氢钠水解呈碱性,苯酚钠水解呈碱性;氯化铵水解呈酸性;碳酸钠溶液水解程度大于苯酚钠,苯酚钠水解程度大于碳酸氢钠,c(H+)分别为c1、c2、c3、c4,则c4>c2>c3>c1;故D错误;
、NH4Cl溶液中,碳酸钠水解呈碱性,碳酸氢钠水解呈碱性,苯酚钠水解呈碱性;氯化铵水解呈酸性;碳酸钠溶液水解程度大于苯酚钠,苯酚钠水解程度大于碳酸氢钠,c(H+)分别为c1、c2、c3、c4,则c4>c2>c3>c1;故D错误;故选BC.
点评:本题考查了电解质溶液中的两种浓度大小比较判断,溶液中的电荷守恒、物料守恒的计算应用,盐类水解程度的分析方法,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列溶液中有关物质的浓度关系正确的是( )
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) | B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | C、1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |