题目内容
【题目】(6分)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是 。
(3)该化合物的化学式(分子式)是 。
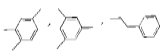
(4)该化合物分子中最多含 个![]() 官能团。
官能团。
【答案】(1)4;(2)134;(3)C5H10O4;(4)1
【解析】
(1)由题意知,氧的质量分数为1-52.24%=47.76%,由有机化合物的相对分子质量大于110,小于150,即分子中氧原子个数为大于![]() =3.28,小于
=3.28,小于![]() =4.48,所以氧原子为4个,故答案为:4;
=4.48,所以氧原子为4个,故答案为:4;![]() <N(O)<
<N(O)<![]() ,且为整数;
,且为整数;
(2)分子中氧原子为4个,氧的质量分数为47.76%,则有机化合物分子质量=![]() =134,故答案为:134;
=134,故答案为:134;
(3)分子中氧原子为4个,所以C、H的相对原子质量之和为:134-16×4=70,C原子最大数目=![]() =5…10,故分子中含有5个C原子、10个H原子,可确定化学式为C5H10O4;故答案为:C5H10O4;
=5…10,故分子中含有5个C原子、10个H原子,可确定化学式为C5H10O4;故答案为:C5H10O4;
(4)C5H10O4与5个C原子的饱和衍生物(可表示为C5H12On)比较可知,分子的不饱和度为1,![]() 的不饱和度为1,因此分子中最多含有1个
的不饱和度为1,因此分子中最多含有1个![]() ,故答案为:1。
,故答案为:1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105