题目内容
【题目】下列实验过程中产生的现象与图示相符的是( )
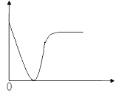
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标是钠离子的物质的量)
B.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
C.NaOH溶液滴入Ba(HCO3)2溶液中(横坐标是NaOH溶液的体积,纵坐标为沉淀质量)
D.铁粉加入到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
【答案】B
【解析】
A.横坐标是稀盐酸的体积,纵坐标为钠离子物质的量,稀盐酸滴加到一定量NaOH溶液中HCl+NaOH=NaCl+H2O,钠离子的物质的量不变,而图象中的钠离子先变小后变大,故A错误;
B.横坐标是稀硫酸的体积,纵坐标为溶液的导电能力,滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,离子浓度减小,导电性下降,恰好完全反应导电性几乎为零,再随着稀硫酸的滴入,离子浓度增大,溶液导电性增加,直到变为定值,故B正确;
C.NaOH溶液滴入Ba(HCO3)2溶液中,生成碳酸钡沉淀,沉淀质量逐渐增大,到最后不变,故C错误;
D.横坐标是铁粉的质量,纵坐标为溶液中固体的总质量,铁粉加到一定量CuSO4溶液中Fe+CuSO4═FeSO4+Cu,从方程式看出,每当消耗56克铁,生成64克固体,所以固体的质量一直在增加,而图象中的固体的质量先变小后变大,故D错误;
答案:B

 阅读快车系列答案
阅读快车系列答案【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |




