题目内容
【题目】请按要求回答下列问题:
(1)在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图中,表示NO2变化曲线的是_______ 。用O2表示从0s ~2s内该反应的平均速率V=__________。
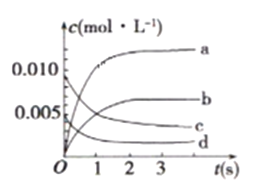
②能说明该反应已达到平衡状态的是___________
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.容器中氧气体积分数不变 D.容器内密度保持不变
(2)为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,试完成有关问题:
实验编号 | 电极材料 | 电解质溶液 |
1 | Al、Mg | 稀盐酸 |
2 | Al、Cu | 稀盐酸 |
3 | Al、C(石墨) | 稀盐酸 |
4 | Al、 | 氢氧化钠溶液 |
5 | Al、Zn | 浓硝酸 |
①实验1中Al所作的电极是______(填“正极”或“负极”)。
②实验2中H+移向______(填“Al”或“Cu”),Cu极发生_____反应(填“氧化”或“还原”)。
③实验3中石墨的电极反应式: _________________。
④实验4中铝作______极,写出总反应的化学方程式:_______________________。
⑤实验5中负极的电极反应式为:__________________________。
【答案】b 1.5×10-3mol/(L·s) B、C 正极 Cu 还原 2H++2e-=H2↑ 负 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Zn-2e-=Zn2+
【解析】
(1)①由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO),根据反应中NO、NO2物质的量变化关系确定NO2的变化曲线;根据v=![]() 计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
②可逆反应达到平衡时,v正=V逆(同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断;
(2)金属与酸构成的原电池中,活泼金属作负极,不活泼的金属或非金属为正极;在实验4金属与碱溶液混合时,Al为负极,Mg为正极,电池反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极。
(1) ①由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,△c(NO)=![]() =0.0065mol/L,NO2是产物,随反应进行浓度增大,平衡时浓度不变,等于NO浓度的变化量,c(NO2)=△c(NO)=0.0065mol/L,所以图中表示NO2变化的曲线是b;
=0.0065mol/L,NO2是产物,随反应进行浓度增大,平衡时浓度不变,等于NO浓度的变化量,c(NO2)=△c(NO)=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=![]() =3.0×10-3mol/(L·s),根据反应在用不同物质表示的反应速率比等于化学计量数的比可知v(NO):v(O2)=2:1,所以v(O2)=
=3.0×10-3mol/(L·s),根据反应在用不同物质表示的反应速率比等于化学计量数的比可知v(NO):v(O2)=2:1,所以v(O2)= ![]() v(NO)= 1.5×10-3mol/(L·s);
v(NO)= 1.5×10-3mol/(L·s);
②A.无论反应是否达到平衡状态,反应速率始终关系是v(NO2)=2v(O2) ,不能据此判断平衡状态,A错误;
B.该反应是反应前后气体物质的量不等的反应,容器的容积不变,若容器内压强保持不变,则反应处于平衡状态,B正确;
C.若反应未达到平衡,则反应体系中任何一组分的物质的量就会发生变化,气体的总物质的就变化,若容器中氧气体积分数不变,则反应达到平衡,C正确;
D.容器的容积不变,反应混合物都是气体,气体的质量不变,因此任何情况下容器内密度都保持不变,故不能据此判断反应是否处于平衡状态,D错误;
故合理选项是BC;
(2)①实验1中由于金属活动性Mg>Al,所以在构成的原电池中,Mg为负极,Al为正极;
②实验2金属活动性Al>Cu,Al为负极,失去电子,Cu为正极,电子由Al经导线流向Cu电极,溶液中H+在正极Cu上获得电子变为H2逸出,所以H+移向Cu电极,Cu极发生还原反应;
③实验3由于电极活动性Al>C,所以石墨电极是正极,H+获得电子,发生还原反应,石墨电极的电极反应式为:2H++2e-=H2↑;
④实验4中Mg与NaOH溶液不能反应,而Al电极反应,所以铝作负极,总反应的化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
⑤实验5中Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,负极的电极反应式为:Zn-2e-=Zn2+。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案