题目内容
【题目】下列有关硅和二氧化硅的用途错误的是( )
A.硅单质作耐火材料B.晶体硅作半导体材料
C.二氧化硅作光导纤维材料D.高纯硅作计算机芯片材料
【答案】A
【解析】
A.硅单质在加热条件下能与氧气反应,故A错误,符合题意;
B.硅单质是半导体材料,故B正确,不符合要求;
C.二氧化硅是光导纤维的原料,故C正确,不符合要求;
D.高纯硅可以作计算机芯片材料,故D正确,不符合要求;
故选:A。

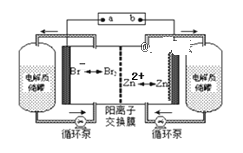
【题目】请按要求回答下列问题:
(1)在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图中,表示NO2变化曲线的是_______ 。用O2表示从0s ~2s内该反应的平均速率V=__________。
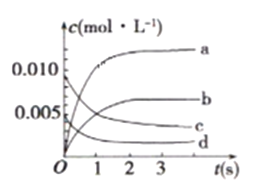
②能说明该反应已达到平衡状态的是___________
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.容器中氧气体积分数不变 D.容器内密度保持不变
(2)为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,试完成有关问题:
实验编号 | 电极材料 | 电解质溶液 |
1 | Al、Mg | 稀盐酸 |
2 | Al、Cu | 稀盐酸 |
3 | Al、C(石墨) | 稀盐酸 |
4 | Al、 | 氢氧化钠溶液 |
5 | Al、Zn | 浓硝酸 |
①实验1中Al所作的电极是______(填“正极”或“负极”)。
②实验2中H+移向______(填“Al”或“Cu”),Cu极发生_____反应(填“氧化”或“还原”)。
③实验3中石墨的电极反应式: _________________。
④实验4中铝作______极,写出总反应的化学方程式:_______________________。
⑤实验5中负极的电极反应式为:__________________________。