题目内容
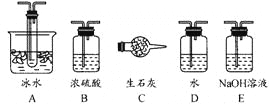
【题目】用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+ H2SO4(85%)=Na2SO4+ SO2↑+ H2O

根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合Ⅰ、Ⅱ、Ⅲ处连接的装置分别是____________、_____________、__________。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是_________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(写2点)。
①原因____________,验证方法___________________;
②原因____________,验证方法___________________;
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式_______________;
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为__________%(用含a、b的代数式填写)。
【答案】B A E 加热催化剂 Na2SO3变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质 不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸 SO2+ 2HClO3= H2SO4+ 2ClO2 ![]() ×100%(或
×100%(或![]() %)
%)
【解析】
(1)二氧化硫的干燥用浓硫酸,当温度低于16.8℃可以获得三氧化硫的晶体,尾气处理用烧碱溶液;
(2)为保证生成的二氧化硫尽可能的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作;
(3)亚硫酸钠变质会生成硫酸钠,根据检验亚硫酸钠中硫酸根是否存在来证明结论;亚硫酸钠和稀硫酸反应产生的二氧化硫速率很慢;
(4)SO2通入含1.0mol次氯酸的溶液中,根据转移的电子数来确定两种强酸;
(5)根据S元素守恒计算消耗的SO2的物质的量,依据公式计算转化率。
(1)SO2转化成SO3之前必须对二氧化硫进行干燥,可以用浓硫酸,SO3的熔点是16.8℃,沸点是44.8℃,当温度低于16.8℃时,三氧化硫以晶体状态存在,二氧化硫、三氧化硫的尾气处理用烧碱溶液吸收,故答案为B、A、E;
(2)为保证生成的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再进行滴加浓硫酸操作,保证生成的二氧化硫尽可能的参与反应,故答案为加热催化剂;
(3)影响化学反应速率的因素有:浓度、温度等,亚硫酸钠变质会生成硫酸钠,硫酸钠和浓硫酸不反应;此外亚硫酸钠和稀硫酸反应产生的二氧化硫速率会很慢,故答案为Na2SO3变质;取待测试样于试管中,加适量的蒸馏水配成溶液,滴加足量的稀盐酸,再加入氯化钡溶液,如果有白色沉淀生成,则证明该亚硫酸钠已变质;不是浓硫酸;用洁净的玻璃棒沾取待测试样,滴到白纸上,如果不变黑,则证明该溶液不是浓硫酸;
(4)SO2通入含1.5mol氯酸的溶液中,转移的电子为1.5mol,说明反应中1mol氯酸转移1mol电子,生成ClO2,因此反应的化学方程式为SO2+ 2HClO3= H2SO4+ 2ClO2,故答案为SO2+ 2HClO3= H2SO4+ 2ClO2;
(5)根据硫原子守恒,Na2SO3~SO2~SO3,amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,应产生二氧化硫的质量为64ag,测得装置Ⅲ增重了bg,即为剩余二氧化硫的质量,所以参加反应的二氧化硫的质量为:64ag-bg,二氧化硫的转化率α=![]() ×100%=
×100%=![]() %,故答案为
%,故答案为![]() %。
%。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案