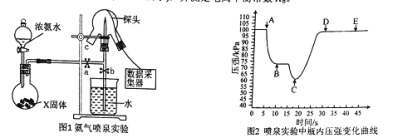
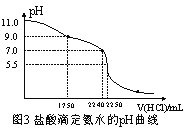
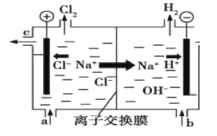
题目内容
【题目】A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
【答案】(1)氮;硫;
(2)![]() ;O22-;(3)正四面体;
;O22-;(3)正四面体;
(4)![]() ;(5) H2O>H2S。
;(5) H2O>H2S。
【解析】试题分析:A是元素周期表中原子半径最小的元素,即为H,B元素的最外层电子数是次外层电子数的2倍,则B为C,D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y,推出D为O,则C为N,D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N,推出E为Na,F的最高价为+6价,则F为S,(1)根据上述分析,C为氮,F为硫;(2)Y为H2O,其电子式为![]() ,M为Na2O2,其阴离子符号:O22-;(3)构成的形式为NH4+,为正四面体结构;(4)E2F为Na2S,
,M为Na2O2,其阴离子符号:O22-;(3)构成的形式为NH4+,为正四面体结构;(4)E2F为Na2S,![]() ;(5)氢化物分别是H2O、H2S,H2O含分子间氢键,因此H2O的沸点大于H2S。
;(5)氢化物分别是H2O、H2S,H2O含分子间氢键,因此H2O的沸点大于H2S。

练习册系列答案
相关题目