题目内容
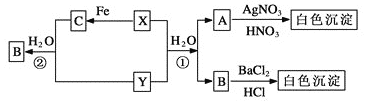
【题目】硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5·H2O, 硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程如下:

回答下列有关问题:
(1)硼砂中B的化合价为__________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为__________________。
(2)氧化物X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为______________,该反应中的氧化剂是(填化学式)_______________。
(3)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,这一变化的化学方程式为____________________。皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为 。
(4)MgCl2·7H2O需要在HCl氛围中加热制MgCl2,其目的是 。
【答案】
(1)+3(2分)B4O72-+2H++5H2O==4H3BO3(2分)
(2)3Mg+B2O3![]() 2B+3MgO(2分) B2O3(2分)
2B+3MgO(2分) B2O3(2分)
(3)H3BO3+H2O![]() [B(OH)4]-+H+(2分) H3BO3+OH-===[B(OH)4]-(2分)
[B(OH)4]-+H+(2分) H3BO3+OH-===[B(OH)4]-(2分)
(4)防止MgCl2水解生成Mg(OH)2(2分)
【解析】
试题分析:(1)根据硼砂的化学式Na2B4O7·10H2O和化合价的代数和为0,可得B的化合价为+3;B4O72-与H+反应可得H3BO3,离子方程式为:B4O72-+2H++5H2O==4H3BO3;
(2)X为H3BO3晶体加热脱水的产物,为B2O3,与Mg发生氧化还原反应制取粗B,则化学方程式为:3Mg+B2O3![]() 2B+3MgO,该反应中B元素的化合价由+3价降低到0价,则该反应中的氧化剂是B2O3。
2B+3MgO,该反应中B元素的化合价由+3价降低到0价,则该反应中的氧化剂是B2O3。
(3)由题意可知硼酸与水作用时结合水电离的OH-而释放出水电离的H+,所以这一变化的化学方程式为H3BO3+H2O![]() [B(OH)4]-+H+,硼酸是一种一元弱酸,能与氢氧化钠反应,其反应方程式为 H3BO3+NaOH=Na[B(OH)4],离子方程式为 H3BO3+OH-===[B(OH)4]-,
[B(OH)4]-+H+,硼酸是一种一元弱酸,能与氢氧化钠反应,其反应方程式为 H3BO3+NaOH=Na[B(OH)4],离子方程式为 H3BO3+OH-===[B(OH)4]-,
(4)MgCl2为强酸弱碱盐,能发生水解反应,所以MgCl2·7H2O在HCl氛围中加热的目的是防止MgCl2水解生成Mg(OH)2 。