题目内容
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
(1)O2->Na+>Al3+ HNO3>H2CO3>H2SiO3 HCl>H2S>SiH4 (3分)
(2)HClO4 (1分) OH-+H+ = H2O (1分)MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O (2分)
MnCl2 + Cl2 ↑+ 2H2O (2分)
(3)Al(OH)3+OH- = AlO2-+2H2O (2分)
(4)离子键和非极性共价键 (2分) Na2O2+SO2=Na2SO4(2分)
(2)HClO4 (1分) OH-+H+ = H2O (1分)MnO2 + 4HCl(浓)
 MnCl2 + Cl2 ↑+ 2H2O (2分)
MnCl2 + Cl2 ↑+ 2H2O (2分)(3)Al(OH)3+OH- = AlO2-+2H2O (2分)
(4)离子键和非极性共价键 (2分) Na2O2+SO2=Na2SO4(2分)
试题分析:根据各元素在元素周期表中的位置可推知:a为H,b为C,c为N,d为O,e为Na,f为Al,g为Si,h为S,i为Cl。
(1)d、e、f的离子为O2?、Na+、Al3+,电子排布相同,原子序数越大,离子半径越小,所以O2->Na+>Al3+;b、c、g的最高价含氧酸分别为H2CO3、HNO3、H2SiO3,根据元素周期律酸性:HNO3>H2CO3>H2SiO3;a与g、h、i形成的简单化合物分别为SiH4、H2S、HCl,稳定性由强到弱的顺序为:HCl>H2S>SiH4。
(2)i元素的最高价氧化物对应的水化物为HClO4;e的最高价氧化物对应水化物为NaOH,反应的离子方程式为:OH-+H+ = H2O;实验室由MnO2与浓盐酸反应制取Cl2,化学方程式为:MnO2 + 4HCl(浓)
 MnCl2 + Cl2 ↑+ 2H2O。
MnCl2 + Cl2 ↑+ 2H2O。(3)呈两性的氢氧化物是Al(OH)3,溶于强碱的离子方程式为:Al(OH)3+OH- = AlO2-+2H2O。
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键和非极性共价键;h的低价态氧化物为SO2,Na2O2能把SO2氧化为Na2SO4,化学方程式为:Na2O2+SO2=Na2SO4。

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
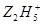 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,