题目内容
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
(1)第2周期VA族 (2)离子键 Mg(OH)2、Al(OH)3
(3)2Mg+CO2 2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑
2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑
(3)2Mg+CO2
 2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑
2MgO+C (4)2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑试题分析:根据题意可推知个元素分别是:A:C;B:N;C:O;D:Na;E:Mg;F:Al.
(1)N元素在元素周期表中的位置是第二周期第VA族。
(2)O、Na两元素形成的化合物为Na2O、Na2O2,二者都是离子化合物,都含有离子键。元素的金属性Mg>Al.元素的金属性越强,其最高价氧化物对应水化物的碱性就越强。故Mg(OH)2和Al(OH)3的碱性强弱关系为Mg(OH)2>Al(OH)3。
(3)Mg和CO2发生反应的化学方程式为:2Mg+CO2
 2MgO+C
2MgO+C(4)Al和NaOH溶液反应的离子方程式为:2Al+2OH-+6H2O ="==" 2[Al(OH)4]-+3H2↑(或2Al+2OH-+2H2O =2AlO2-+3H2↑)

练习册系列答案
相关题目
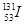 ,还检测到了极微量的人工放射性核素
,还检测到了极微量的人工放射性核素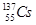 、
、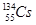 。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是( )
。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是( )