题目内容
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:①2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。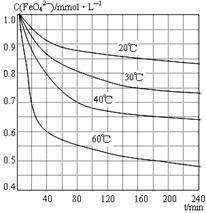

已知:①2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。

温度较低 (2)2NaCl+2H2O Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。
Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。
 Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。
Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。试题分析:(1)在温度较低下发生反应① 2KOH + Cl2 =" KCl" + KClO + H2O,在温度较高时发生反应②6KOH+ 3Cl2 =" 5KCl" + KClO3 + 3H2O。现在要制备KClO。为了防止产生杂质KClO3。所以反应要在温度较低下进行。(2)在工业上Cl2是用电解饱和食盐水的方法制取的,反应的化学方程式是2NaCl+2H2O
 Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3 KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。2FeO4)的生产工艺及制取过程中涉及的化学反应原理的知识。
Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3 KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。2FeO4)的生产工艺及制取过程中涉及的化学反应原理的知识。
练习册系列答案
相关题目
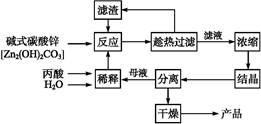
 ,反应温度 ℃。
,反应温度 ℃。 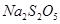 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: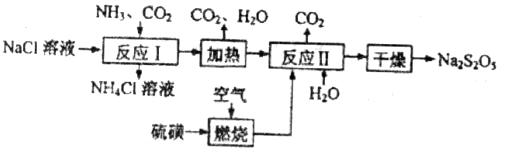
 等多步反应。
等多步反应。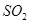 ,其离子方程式为___________。
,其离子方程式为___________。