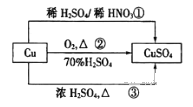
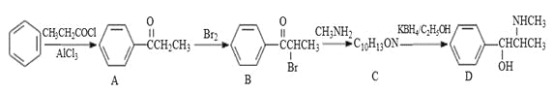
题目内容
【题目】由钠、铜、铝、铁四种金属单质中的两种组成的合金共15g,跟足量的盐酸反应产生5.6L氢气(标准状况下),那么此合金中一定含有的金属是
A. 钠 B. 铜 C. 铝 D. 铁
【答案】B
【解析】标准状况下5.6L氢气的物质的量=![]() =0.25mol,故15g金属提供的电子为0.25mol×2=0.5mol,则提供1mol电子需要金属的质量为15g×2=30g。A.Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g;B.Cu在反应中表现+2价,提供1mol电子需要Cu的质量为64g/mol×
=0.25mol,故15g金属提供的电子为0.25mol×2=0.5mol,则提供1mol电子需要金属的质量为15g×2=30g。A.Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g;B.Cu在反应中表现+2价,提供1mol电子需要Cu的质量为64g/mol×![]() mol=32g;C.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×
mol=32g;C.Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×![]() mol=9g;D.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×
mol=9g;D.Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×![]() mol=28g。综上所述,提供1mol电子,只有Cu的质量大于30g,其它金属的质量都小于30g,故金属混合物中一定有Cu,答案选B.
mol=28g。综上所述,提供1mol电子,只有Cu的质量大于30g,其它金属的质量都小于30g,故金属混合物中一定有Cu,答案选B.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】I.某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)的关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c(A)/mol·L-1 | 1.45 | 1.28 | 1.00 | 1.00 |
c(B)/mol·L-1 | 0.38 | 0.72 | 1.28 | 1.28 |
c(C)/mol·L-1 | 0.095 | 0.18 | 0.32 | 0.32 |
(1) 该反应的化学方程式为 __________________________________
(2)4 min末A的转化率约为______________
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的形态 | 反应温度/℃ | 收集100 mL氢气所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
(3)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响。
(4)实验Ⅰ和Ⅱ表明________,化学反应速率越大。
(5)能表明固体的表面积对反应速率有影响的实验编号是________和________。
(6)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:___________________。