题目内容
某化学兴趣小组设计实验验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl.(1)甲同学设计如图装置:
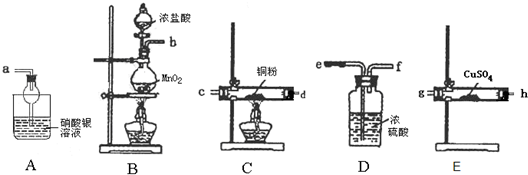
①请按实验目的连接装置:b→g→h→
②装置C、E的作用依次是
(2)乙同学认为即使A装置中有白色沉淀产生,也不能说明一定含有HCl存在.他提出在C和A两个装置之间再增加一个装置,装置中放入某种湿润的试纸就可判断甲同学的设计是否有缺陷,你认为这种试纸是
(3)丙同学认为不需要增加装置,只需要把A装置中的试剂换成
(4)该实验小组欲粗略测定反应后溶液中盐酸浓度,他们将反应后溶液冷却过滤,取滤液10.0mL装入锥形瓶用1.00mol/L标准NaOH溶液滴定.
①甲同学选用酚酞作指示剂滴定,当出现
②乙同学查阅资料知Mn(OH)2难溶解于水,能溶解于酸,故他认为不需要添加指示剂,当出现
分析:(1)①根据实验目的设计实验验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,所以连接按实验发生装置→验证含有水蒸气→除去水蒸气→除去氯气→验证含有HCl装置排序;
②Cu+Cl2
CuCl2,利用铜粉除去氯气;硫酸铜吸水生成蓝色硫酸铜晶体,检验含有水蒸气;
(2)氯气与水反应会生成盐酸,干扰A中氯化氢的检验,故在C、A之间用碘化钾淀粉试液检验氯气是否被完全吸收;
(3)该实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,为排除氯化氢中氯气的干扰,可利用氯气和水反应生成次氯酸,次氯酸具有强氧化性而氯化氢没有该性质,据此分析解答;
(4)①根据指示剂为酚酞,滴定结束前溶液为无色,滴定结束时溶液变成红色进行判断滴定终点;
②该实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,用1.00mol/L标准NaOH溶液滴定,当盐酸反应完全后,再滴入氢氧化钠,氢氧化钠与二氯化锰反应生成Mn(OH)2白色沉淀.
②Cu+Cl2
| ||
(2)氯气与水反应会生成盐酸,干扰A中氯化氢的检验,故在C、A之间用碘化钾淀粉试液检验氯气是否被完全吸收;
(3)该实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,为排除氯化氢中氯气的干扰,可利用氯气和水反应生成次氯酸,次氯酸具有强氧化性而氯化氢没有该性质,据此分析解答;
(4)①根据指示剂为酚酞,滴定结束前溶液为无色,滴定结束时溶液变成红色进行判断滴定终点;
②该实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,用1.00mol/L标准NaOH溶液滴定,当盐酸反应完全后,再滴入氢氧化钠,氢氧化钠与二氯化锰反应生成Mn(OH)2白色沉淀.
解答:解:(1)①实验装置的连接顺序为:实验发生装置→验证含有水蒸气→除去水蒸气→除去氯气→验证含有HCl装置排序;B为氯气的制取装置,浓盐酸与足量MnO2反应制取Cl2,反应需要加热,氯化氢易挥发,所以制取的氯气中含有水蒸气和氯化氢,利用无水硫酸铜验证水蒸气b→g→h,除去水蒸气用浓硫酸所以连接h→e→f,利用铜粉除去氯气所以连接→f→c(与d可颠倒),
实验需验证实验过程中有HCl挥发出来,连接C装置除去氯气,最后用A证明有氯化氢,
故答案为:efcd (c和d可以颠倒);
②设计的实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,所以用铜粉除去氯气Cu+Cl2
CuCl2,E中盛放的是无水硫酸铜,无水硫酸铜和水反应生成蓝色硫酸铜晶体,所以该装置是检验水的存在,
故答案为:吸收氯气;检验水蒸气;
(2)氯气与水反应会生成盐酸,干扰G中氯化氢的检验,为了确保实验结论的可靠性,应排除氯气的干扰,在氯化氢通入硝酸银溶液之前,要证明氯气已被除尽,根据氯气具有强氧化性的性质,故在C、A之间加一装置,用碘化钾淀粉试液检验氯气是否被完全吸收,用湿润的KI淀粉试纸(若氯气未除尽,则试纸变蓝),
故答案为:淀粉KI试纸;
(3)实验验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,考虑到氯气溶于水生成的次氯酸,具有漂白性,再结合氯化氢溶于水具有酸性,可选择紫色石蕊试液,若石蕊最终褪色,说明气体中含有氯气,甲实验不可靠,
故答案为:紫色石蕊溶液;先变红后褪色;
(4)滴定结束前盐酸中滴入酚酞,溶液为无色,滴定结束时氢氧化钠过量,溶液变成红色,所以滴定终点现象为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色;用1.00mol/L标准NaOH溶液滴定,当盐酸反应完全后,再滴入氢氧化钠,氢氧化钠与二氯化锰反应生成Mn(OH)2白色沉淀,出现浑浊现象就认为达到滴定终点,
故答案为:溶液由无色变成浅红色,并在半分钟后不褪去;浑浊.
实验需验证实验过程中有HCl挥发出来,连接C装置除去氯气,最后用A证明有氯化氢,
故答案为:efcd (c和d可以颠倒);
②设计的实验是验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,所以用铜粉除去氯气Cu+Cl2
| ||
故答案为:吸收氯气;检验水蒸气;
(2)氯气与水反应会生成盐酸,干扰G中氯化氢的检验,为了确保实验结论的可靠性,应排除氯气的干扰,在氯化氢通入硝酸银溶液之前,要证明氯气已被除尽,根据氯气具有强氧化性的性质,故在C、A之间加一装置,用碘化钾淀粉试液检验氯气是否被完全吸收,用湿润的KI淀粉试纸(若氯气未除尽,则试纸变蓝),
故答案为:淀粉KI试纸;
(3)实验验证二氧化锰和浓盐酸制备的Cl2中含有水蒸气和HCl,考虑到氯气溶于水生成的次氯酸,具有漂白性,再结合氯化氢溶于水具有酸性,可选择紫色石蕊试液,若石蕊最终褪色,说明气体中含有氯气,甲实验不可靠,
故答案为:紫色石蕊溶液;先变红后褪色;
(4)滴定结束前盐酸中滴入酚酞,溶液为无色,滴定结束时氢氧化钠过量,溶液变成红色,所以滴定终点现象为:最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色;用1.00mol/L标准NaOH溶液滴定,当盐酸反应完全后,再滴入氢氧化钠,氢氧化钠与二氯化锰反应生成Mn(OH)2白色沉淀,出现浑浊现象就认为达到滴定终点,
故答案为:溶液由无色变成浅红色,并在半分钟后不褪去;浑浊.
点评:本题考查氯气的制取原理、实验装置评价与理解、氯气的性质、氯离子检验、中和滴定等,关键是清楚实验的目的与原理,掌握氯气性质应用,题目难度中等.

练习册系列答案
相关题目
 MnO4-+
MnO4-+