题目内容
18.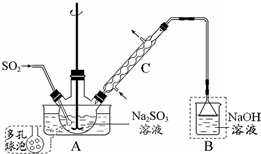 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3NaHSO3+Zn+HCHO+3H2O=NaHSO2•HCHO•2H2O+Zn(OH)2↓
已知:次硫酸氢钠甲醛易溶于水,微溶于乙醇,具有强还原性,且在120℃以上发生分解;
实验步骤如下:
步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液.
步骤2:将装置A中导气管换成橡皮塞.向三颈烧瓶中加入稍过量的锌粉和一定量37%甲醛溶液,在80℃~90℃下,反应约3h.趁热过滤,温水洗涤.
步骤3:
①将滤液真空蒸发浓缩,冷却结晶,过滤;
②往滤液中加入适量乙醇,析出晶体,过滤;
③合并滤渣,乙醇洗涤,干燥得到产品.
请回答下列问题:
(1)仪器C的名称冷凝管.
(2)装置A中多孔球泡的作用是增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度,装置B 的作用是吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A.
(3)①步骤2中,反应生成的Zn(OH)2 会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是搅拌;
②步骤2中,应采用何种加热方式水浴加热;
③趁热过滤的目的是除去多余的锌粉和生成的氢氧化锌,防止硫酸氢钠甲醛冷却结晶,造成损失.
(4)步骤3的①中不在敞口容器中蒸发浓缩的原因是防止产物被空气氧化;
步骤3的②中加入乙醇,有晶体析出的原因是加入乙醇降低了次硫酸氢钠甲醛的溶解度,从而析出晶体.
分析 (1)根据装置图可知仪器名称;
(2)多孔球泡可增大气体和液体的接触面积;装置B 是尾气吸收装置,倒置的漏斗可以防倒吸;
(3)①搅拌可以防止Zn(OH)2 覆盖在锌粉表面;
②根据次硫酸氢钠甲醛的分解温度应选择水浴加热,水浴加热均匀,且容易控制;
③过滤的目的是除去锌粉和生成的氢氧化锌,同时要防止次硫酸氢钠甲醛从溶液中析出;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;次硫酸氢钠甲醛易溶于水,微溶于乙醇,加入乙醇可以降低次硫酸氢钠甲醛溶解度.
解答 解:(1)根据装置图可知仪器C的名称为冷凝管,
故答案为:冷凝管;
(2)多孔球泡可增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度,装置B 是尾气吸收装置,倒置的漏斗可以防倒吸,所以装置B 的作用是吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A,
故答案为:增大二氧化硫气体和Na2SO3液体的接触面积,加快反应速度;吸收未反应的二氧化硫,防止污染空气并阻止空气进入装置A;
(3)①防止Zn(OH)2 覆盖在锌粉表面阻止反应进行,可以通过搅拌的方法,
故答案为:搅拌;
②根据次硫酸氢钠甲醛的分解温度应选择水浴加热,水浴加热均匀,且容易控制,
故答案为:水浴加热;
③过滤的目的是除去锌粉和生成的氢氧化锌,同时要防止次硫酸氢钠甲醛从溶液中析出,所以要趁热过滤,
故答案为:除去多余的锌粉和生成的氢氧化锌,防止硫酸氢钠甲醛冷却结晶,造成损失;
(4)次硫酸氢钠甲醛具有还原性,在敞口容器中蒸发浓缩,可以被空气中的氧气氧化变质,次硫酸氢钠甲醛易溶于水,微溶于乙醇,加入乙醇可以降低次硫酸氢钠甲醛溶解度,所以步骤3的②中加入乙醇,有晶体析出的原因是加入乙醇降低了次硫酸氢钠甲醛的溶解度,从而析出晶体,
故答案为:防止产物被空气氧化;加入乙醇降低了次硫酸氢钠甲醛的溶解度,从而析出晶体.
点评 本题考查了实验制备方案的设计,实验步骤的操作,仪器使用方法,反应过程中的物质判断,题目难度中等.

| A. |  葡萄酿成酒 | B. |  铁矿石冶炼成钢铁 | ||
| C. |  海水晒盐 | D. |  石油合成塑料和橡胶 |

| A. | 质量分数 | B. | 物质的量 | C. | 摩尔质量 | D. | 物质的量浓度 |
| A. |  向pH=12 的Ca(OH)2溶液中不断加水稀释 | |
| B. | 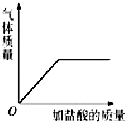 向CaCO3固体中逐滴加入稀盐酸至过量 | |
| C. |  在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  将等质量的金属镁片和锌片分别和足量的相同质量分数的稀硫酸混合 |
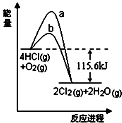
| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)△H=+115.6 kJ/mol | |
| D. | 若反应生成2 mol 液态水,放出的热量高于115.6 kJ |
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸相似,NaN3水溶液中离子浓度大小为c(Na+)>c(N3-)>c(OH-)>c(H+)[ | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| A. | 分子中含有碳元素和氢元素的化合物是烃类 | |
| B. | 相对分子质量相同的物质一定是同种物质 | |
| C. | 相对分子质量相差14的两种有机物,一定是属于同系物 | |
| D. | 分子式相同结构不同的有机物一定是同分异构体 |
| A. | HCO3- | B. | Al3+ | C. | CH3COO- | D. | H2PO4- |