题目内容
10.下列说法不正确的是( )| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸相似,NaN3水溶液中离子浓度大小为c(Na+)>c(N3-)>c(OH-)>c(H+)[ | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
分析 A.碳酸氢根离子部分水解,溶液呈碱性,则c(Na+)>c(HCO3-)、c(OH-)>c(H+);
B.N3-在溶液中部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可知为c(Na+)>c(N3-);
C.溶液的pH=7,为中性溶液,则c(OH-)=c(H+),结合电荷守恒进行判断;
D.醋酸为弱酸,混合液中醋酸过量,反应后的溶液显示酸性.
解答 解:A.0.2 mol•L-1的NaHCO3溶液中,碳酸氢根离子部分水解,溶液呈碱性,则c(Na+)>c(HCO3-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故A正确;
B.叠氮酸(HN3)与醋酸相似,则NaN3水溶液中N3-部分水解,溶液显示碱性,则:c(OH-)>c(H+),根据电荷守恒可知为c(Na+)>c(N3-),离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知:c(NH4+)=c(Cl-),故C正确;
D.常温下pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后,醋酸过量,混合液显示酸性,则所得溶液的pH<7,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒等含义为解答关键,试题充分考查了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.某同学对所学部分化学知识归纳如下,其中有错误的一组是( )
| 物质的性质与用途 | 安全常识 | ||
| A | 氮气性质稳定--填充食品袋防腐 乙醇具有可燃性--可用作燃料 一氧化碳具有还原性--可冶炼金属 | B | 假酒中毒--由乙醇引起 瓦斯爆炸--由天然气引起 假盐中毒--由黄曲霉素引起 |
| 元素与人体健康 | 日常生活经验 | ||
| C | 缺铁-易引起贫血 缺钙-易得佝偻病 缺碘-易引起甲状腺肿大. | D | 去除衣服上的油污-用汽油洗涤 区别硬水软水--常用肥皂水检验 使煤燃烧更旺--把煤做成蜂窝状 |
| A. | A | B. | B | C. | C | D. | D |
1.下列解释正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 物质的量就是物质的数量 | |
| C. | 物质的量可以改为物质量 | |
| D. | 物质的量就是一个物理量,表示一定微粒数目的集体 |
5.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向无色溶液中滴加氯水和CCl4,振荡静置 | 下层溶液显 紫色 | 原溶液中含有I- |
| B | 过量铁粉加入稀硝酸中充分反应,再加入KSCN溶液 | 溶液呈红色 | 稀硝酸将铁 氧化为Fe2+ |
| C | 向淀粉溶液中滴加稀硫酸,加热,取水解液少许,滴加银氨溶液,并水浴加热 | 没有银镜出现 | 淀粉没有发生水解 |
| D | 用玻璃棒蘸取浓硫酸滴到蓝色石蕊试纸上 | 试纸变黑 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
15.表是几种常见弱酸的电离平衡常数(25℃).
回答下列各题?
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,?其中酸性最强的是H3PO4?,最弱的是HS-.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=1×10-13.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为中性.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.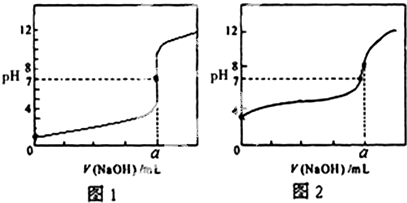
①NaOH溶液滴定CH3COOH溶液的曲线是图2(填“图1”或“图2”);
②a=20.00mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.75×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系是:相同条件下K值越大,电离出的氢离子浓度越大,酸性越强.
(2)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,?其中酸性最强的是H3PO4?,最弱的是HS-.
(3)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,即K1》K2》K3,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(4)某温度(T℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,则
①该温度下水的Kw=1×10-13.
②该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,所得溶液为中性.(填“酸性”、“中性”或“碱性”)
(5)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
.

①NaOH溶液滴定CH3COOH溶液的曲线是图2(填“图1”或“图2”);
②a=20.00mL.
③该实验操作所需的主要玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶.
19.下列物质中,既能同强酸或强碱作用,一定条件下又能作氧化剂或还原剂的是( )
| A. | (NH4)2S | B. | NaHSO3 | C. | Al(OH)3 | D. | FeS |
20.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 .
.
(2)地壳中含量最多的金属元素是Al.写出元素⑥的氢化物的化学式CH4.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出③.④.⑤对应离子氧化性由强到弱的是Al3+>Mg2+>Na+,②、⑦、⑩对应氢化物酸性由强到弱的是HBr>HCl>HF.
(5)写出⑪与氢氧化钠反应的化学方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)地壳中含量最多的金属元素是Al.写出元素⑥的氢化物的化学式CH4.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出③.④.⑤对应离子氧化性由强到弱的是Al3+>Mg2+>Na+,②、⑦、⑩对应氢化物酸性由强到弱的是HBr>HCl>HF.
(5)写出⑪与氢氧化钠反应的化学方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑.
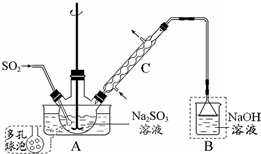 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊白块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:SO2+Na2SO3+H2O=2NaHSO3
 和
和 
