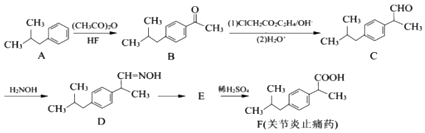
��Ŀ����
����Ŀ����ʮ��������ѧ�����߶�̼�����������˹㷺������о���ȡ����һЩ��Ҫ�ɹ���������CO2��CH4�������ƺϳ�������Ҫ�ɷ�ΪCO��H2������֪���������в��ַ�Ӧ���Ȼ�ѧ����ʽΪ��
I��CH4��g���TC��s��+2H2��g����H=+75.0kJmol��1
II��CO2��g��+H2��g���TCO��g��+H2O��g����H=+41.0kJmol��1
III��CO��g��+H2��g���TC��s��+H2O��g����H=��131.0kJmol��1
��1����ӦCO2��g��+CH4��g���T2CO��g��+2H2��g���ġ�H=kJmol��1 ��
��2���̶�n��CO2��=n��CH4�����ı䷴Ӧ�¶ȣ�CO2��CH4��ƽ��ת���ʼ�ͼ�ף� 
��ͬ�¶���CO2��ƽ��ת����������ڡ���С�ڡ���CH4��ƽ��ת���ʣ���ԭ����
�ڸ����½��и÷�Ӧʱ������ӦI���ɡ���̼����̼���ʣ�����ɴ����ж��������·�ӦI���Է����е�ԭ���� ��
��3��һ��������Pd��Mg/SiO2������ʹCO2�����黯���Ӷ����Ϊ�����䷴Ӧ������ͼ����ʾ���÷�Ӧ�Ļ�ѧ����ʽΪ
��4��CO�����ڹ�ҵұ����������ͼ���ڲ�ͬ�¶���CO��ԭ���ֽ����������ƽ���������lg[c��CO��/c��CO2��]���¶ȣ�t���Ĺ�ϵ����ͼ������˵����ȷ����
A.��ҵ�Ͽ���ͨ�����߷�Ӧװ�����ӳ���ʯ��
CO�Ӵ���ʱ�䣬����β����CO�ĺ���
B.CO���������ڹ�ҵұ����������Cr��
C.��ҵұ������ͭ��Cu��ʱ�ϵ͵��¶�������
���CO��������
D.CO��ԭPbO2�ķ�Ӧ��H��0
��5�������˺�������Ӧ�õ绯ѧԭ������PtΪ������Pb��CO2�����壩Ϊ������KHCO3��ҺΪ�������Һ����ԭ������������CO2ͬʱ����O2���µ���ԴCO���ܷ�Ӧ�Ļ�ѧ����ʽΪ��2CO2 ![]() 2CO+O2 �� ���������ĵ缫��ӦʽΪ ��
2CO+O2 �� ���������ĵ缫��ӦʽΪ ��
���𰸡�
��1��+247
��2�����ڣ�CO2��������������Ӧ����S��0
��3��CO2+4H2 ![]() CH4+2H2O
CH4+2H2O
��4��BC
��5��4OH����4e��=O2��+2H2O
���������⣺��1����֪����CH4��g���TC��s��+2H2��g����H=+75.0kJ/mol
��CO2��g��+H2��g���TCO��g��+H2O��g����H=+41.0kJ/mol
��CO��g��+H2��g���TC��s��+H2O��g����H=��131.0kJ/mol
���ݸ�˹���ɢ�+�ک��۵õ���ӦCO2��g��+CH4��g���T2CO��g��+2H2��g������H=+247kJ/mol��
���Դ��ǣ�+247����2���ٸ���ͼʾ���Կ�����CO2��������������Ӧ��ͬ�¶���CO2��ƽ��ת���ʴ���CH4��ƽ��ת���ʴ��ڣ�
���Դ��ǣ����ڣ�CO2��������������Ӧ��
�ڷ�Ӧ�Է����е��оݣ���H��T��S��0����Ӧ�١�S��0����H��0�������оݣ��õ���Ӧ�ڸ��������Է����У�
���Դ��ǣ���S��0����3������Ϣ��һ��������Pd��Mg/SiO2������ʹCO2�����黯��������д������ʽΪ��CO2+4H2 ![]() CH4+2H2O��
CH4+2H2O��
���Դ��ǣ�CO2+4H2 ![]() CH4+2H2O����4��A������¯�ĸ߶ȣ�����CO������ʯ�ĽӴ�������Ӱ��ƽ���ƶ���CO�������ʲ��䣬��A����
CH4+2H2O����4��A������¯�ĸ߶ȣ�����CO������ʯ�ĽӴ�������Ӱ��ƽ���ƶ���CO�������ʲ��䣬��A����
B����ͼ���֪��CO��ҵұ��������ʱ��lg[c��CO��/c��CO2��]һֱ�ܸߣ�˵��COת���ʺܵͣ��ʲ��ʺ�B��ȷ��
C����ͼ���֪�¶�Խ��lg[c��CO��/c��CO2��]ԽС����COת����Խ�ߣ���C��ȷ��
D����ͼ���֪CO��ԭPbO2���¶�Խ��lg[c��CO��/c��CO2��]Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ����ʡ�H��0����D����
���Դ��ǣ�BC����5����PtΪ������Pb��CO2�����壩Ϊ������KHCO3��ҺΪ�������Һ����ԭ������������CO2ͬʱ����O2���µ���ԴCO���ܷ�Ӧ�Ļ�ѧ����ʽΪ��2CO2 ![]() 2CO+O2 �� ����Һ�е���������������ʧȥ���ӷ���������Ӧ�����������缫��ӦʽΪ��4OH����4e��=O2��+2H2O��
2CO+O2 �� ����Һ�е���������������ʧȥ���ӷ���������Ӧ�����������缫��ӦʽΪ��4OH����4e��=O2��+2H2O��
���Դ��ǣ�4OH����4e��=O2��+2H2O��
�����㾫����ͨ��������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ������������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�������Խ����⣮

����Ŀ��ijѧ����0.2000mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
��������ˮϴ�Ӽ�ʽ�ζ��ܺ�����ע��NaOH��Һ����0���̶������ϣ�
���̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
������Һ������0������0���̶������£������¶�����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش�
��1�����ϲ�����������һ���д���,��ָ����� ���ô�������ᵼ
�²ⶨ��� (����ƫ��������ƫС��������Ӱ����)
��2���ñ�NaOH��Һ�ζ�ʱ��Ӧ����NaOH��Һע�� �С�������ͼ��ѡ������������������

��3�����в���������ʵ����ƫ����ǣ� �����ţ�
A������ƿװҺǰ��������������ˮ |
B���ζ�ǰ����ʽ�ζ��ܼ��������ݣ��ζ��������� |
C����ƿ��������ˮϴ�Ӻ����ô���Һ��ϴ |
D������ʽ�ζ�����ȡ����Һʱ��һ�δ���Һ������ƿ�� |
��4���жϵ���ζ��յ�������ǣ���ƿ����Һ�� ɫ��Ϊ ɫ���Ұ����֮�ڲ��ٸı䡣
��5��������ʵ�����ݼ�¼��

ͨ������ɵã�������Ũ��Ϊ�� mol��L��1������������2λС������
����Ŀ�������������ʵ��л���������ͬ���칹����Ŀ�����ǣ������������칹����������
ѡ�� | A | B | C | D |
����ʽ | C4H8Cl2 | C5H10O2 | C4H8O2 | C9H12 |
��� | ���Ȼ����� | ���� | �� | ���б������� |
A. A B. B C. C D. D