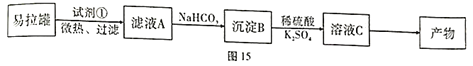
题目内容
【题目】硫酸或硝酸在下列用途或反应中各表现的性质是:
A.强酸性 B.易挥发性 C.吸水性 D.脱水性 E.强氧化性 F.不稳定性
(1)胆矾中加入浓硫酸,久置变为白色粉末__________;
(2)用铝槽车装运浓硫酸或浓硝酸___________;
(3)浓硝酸敞口放置会“发烟”___________,
(4)浓硝酸久置会变黄____________;
【答案】C E B F
【解析】
本题考查的是浓硫酸的性质,浓硝酸的化学性质。浓硫酸有酸性、吸水性、脱水性、强氧化性,浓硝酸有挥发性、强氧化性、不稳定性,根据浓硫酸、浓硝酸的性质判断选项。
(1)胆矾的化学式为CuSO4.5H2O,含有结晶水,浓硫酸具有吸水性,使胆矾变成无水硫酸铜。本小题答案为:C。
(2)浓硫酸或浓硝酸能使铝产生钝化现象,在铝表面生成一层致密的氧化物薄膜,阻止了进一步反应,所以用铝槽车装运浓硫酸或浓硝酸,故答案为E。
(3)因硝酸具有挥发性,挥发出来的硝酸与空气中的水蒸气形成硝酸小液滴,所以98%以上的浓硝酸称为“发烟硝酸”,故答案为:B。
(4)4HNO3![]() 4NO2↑+2H2O+O2↑,分解生成的二氧化氮溶于硝酸,所以久置的浓硝酸会变黄,故答案为:F。
4NO2↑+2H2O+O2↑,分解生成的二氧化氮溶于硝酸,所以久置的浓硝酸会变黄,故答案为:F。

 名校课堂系列答案
名校课堂系列答案【题目】下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是( )
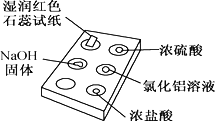
选项 | 实验现象 | 解释 |
A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓ |
D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl=NH4Cl |
A. A B. B C. C D. D
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如下表,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为_______,其简单离子的结构示意图为____。
(2)AE2的化学式为_______。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________________(填离子符号)。
(5)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________。