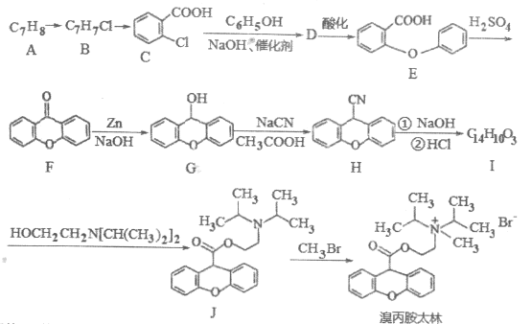
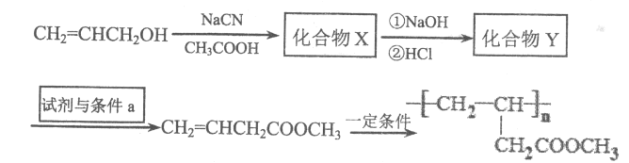
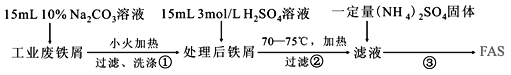
题目内容
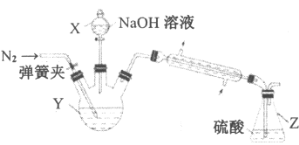
【题目】如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请完成下列问题:
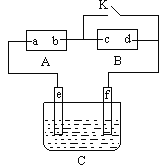
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为______________________________;
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为________,电极f上发生的反应为___________________,电镀槽中放的电镀液可以是________或________(只要求填两种电解质溶液)。
【答案】正极 2NaCl+2H2O![]() 2NaOH + H2↑+ Cl2 ↑ Zn-2e-=Zn2+ Zn2+ +2e-=Zn ZnSO4 ZnCl2、Zn(NO3)2
2NaOH + H2↑+ Cl2 ↑ Zn-2e-=Zn2+ Zn2+ +2e-=Zn ZnSO4 ZnCl2、Zn(NO3)2
【解析】
(1)根据B装置c显红色可知c的电极,由c电极进而可知a、b的电极;(2)根据溶液中离子的放电顺序推断出生成物,进而写出相应反应方程式。(3)由a、b的电极可得知e、f的电极,由阴、阳极上发生的反应写出相应的电极反应;由电镀原理选取电解质。
(1)因A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,接通电路后,发现B上的c点显红色,故B为电解池,并且说明c点有OH-生成,根据离子的放电顺序知,该极上H+得e-放电, c为阴极,外电源b是负极,a是正极。
(2)B实质上是电解氯化钠溶液,溶液中的离子放电能力:H+>Na+,Cl->OH-,故电解氯化钠时生成物是氯气、氢气、氢氧化钠,反应方程式2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(3)题目要求为铁上镀锌,电镀时e是阳极,f是阴极,锌作阳极,铁作阴极,阳极上失电子变成离子进入溶液,阴极上锌离子得电子生成锌单质而附在铁镀件上,故阳极反应式为Zn﹣2e﹣=Zn2+;阴极反应式为Zn2++2e﹣=Zn;电镀液选取原则:用含有镀层金属离子的溶液作电镀液,所以可选ZnSO4、Zn(NO3)2溶液作电镀液.答案:Zn﹣2e﹣=Zn2+;Zn2++2e﹣=Zn;ZnSO4、Zn(NO3)2。

 阅读快车系列答案
阅读快车系列答案