题目内容
15.将0.2mol/L HA 溶液与0.1mol?L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):①混合溶液中c(A-)<c(HA);
②混合溶液中c(HA)+c(A-)=0.1mol?L-1.
分析 (1)溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,混合溶液中c(Na+)>c(A-),则A-离子的水解程度大于HA的电离程度;
(2)依据溶液中物料守恒计算.
解答 解:(1)将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,则溶液中的溶质是HA、NaA,物质的量浓度是0.05mol/L,混合溶液中c(Na+)>c(A-),则A-离子的水解程度大于HA的电离程度,溶液显碱性,则c(A-)<c(HA),
故答案为:<;
(2)反应后溶质为HA、NaA,物质的量浓度是0.05mol/L,根据物料守恒得:c(HA)+c(A-)=0.1mol/L,故答案为:=.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,试题培养了学生的灵活运用能力.

练习册系列答案
相关题目
5.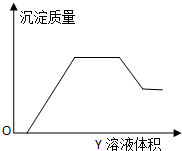 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )| 甲 | 乙 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
6.下列过程中涉及反应不属于氧化还原反应的是( )
| A. | 实验室用NH4Cl和Ca(OH)2制备NH3 | |
| B. | 工业上电解熔融状态的MgCl2制备Mg | |
| C. | 工业上利用合成氨实现人工固氮 | |
| D. | Na2O2用作呼吸面具的供氧剂 |
20.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①在常温常压下,11.2L N2含有的分子数为0.5NA
②在常温常压下,1 mol Ne含有的原子数为NA
③71g Cl2所含原子数为2NA
④在同温同压时,相同体积的任何气体单质所含的原子数相同.
①在常温常压下,11.2L N2含有的分子数为0.5NA
②在常温常压下,1 mol Ne含有的原子数为NA
③71g Cl2所含原子数为2NA
④在同温同压时,相同体积的任何气体单质所含的原子数相同.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
7.下列说法正确的是( )
| A. | 钠能将钛钽铌等金属从盐溶液中置换出来 | |
| B. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| C. | 明矾可用作净水剂,但不能消毒杀菌. | |
| D. | 铁在冷的浓硫酸中钝化是物理变化 |
4.在同温同压下,下列各组热化学方程式Q2>Q1的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 | |
| B. | S(g)+O2(g)=SO2(g)△H=-Q1 S(s)+O2(g)=SO2(g)△H=-Q2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q1 C(s)+O2(g)=CO2(g)△H=-Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H=-Q1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H=-Q2 |
5.下列说法正确的是( )
| A. | 苯和苯乙烯是同系物 | B. | 乙醇和乙醚是同分异构体 | ||
| C. | 显酸性的有机化合物一定是羧酸 | D. | HCOOH和C15H31COOH 互为同系物 |