题目内容
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生。
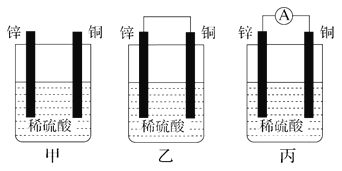
(2)用导线将电流表的两端与溶液中的锌片和铜片相连(如图丙装置所示),观察到电流表的指针发生了偏转,说明导线中有电流通过。锌片上的电极反应:______________;铜片上的电极反应:____________________________。
(3)乙、丙装置是将________能转化为________能的装置。
Ⅱ.断开1molH﹣H键,1molN﹣H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ
(2)1molH2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ(不考虑可逆反应)
【答案】 没有 有 Zn-2e-===Zn2+ 2H++2e-===H2↑ 化学 电 放出 92 放出 30.7
【解析】Ⅰ. (1)铜和稀硫酸不反应, 铜片上没有气泡产生;铜与锌连接形成原电池时,锌为负极,铜为正极,正极发生还原反应生成氢气,可观察到铜片上有气泡产生;正确答案:没有;有。
(2)形成铜-锌原电池时,负极发生氧化反应,锌被氧化生成锌离子,电极方程式为. Zn-2e-===Zn2+ ,正极发生还原反应,生成氢气,电极方程式为2H++2e-===H2↑ ;正确答案: Zn-2e-===Zn2+ ;2H++2e-===H2↑。
(3)锌、铜、稀硫酸构成原电池,电流表指针发生偏转,有电流产生,因此乙、丙装置是将化学能转化为电能的装置;正确答案:化学;电。
Ⅱ.(1)反应热=化学键断裂吸收的总能量-化学键形成放出的总能量, 所以1molN2生成NH3的反应热![]() ,所以该反应为放热反应;放出92 kJ热量;正确答案:92; 放出。
,所以该反应为放热反应;放出92 kJ热量;正确答案:92; 放出。
(2)1molH2生成NH3的的反应热![]() ;正确答案:30.7。
;正确答案:30.7。
点睛; 化学反应中,化学键断裂吸收能量,形成新化学键放出能量;反应热H=反应物断键吸收的总能量-生成物成键放出的总能量。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案