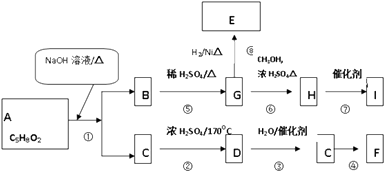
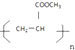
题目内容
【题目】现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。

(1)混合溶液中NH![]() 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO![]() 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200mL范围内,发生反应的离子方程式为_________________。
【答案】 0.4 0.2 NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
【解析】本题考查化学计算,(1)整个过程中NH![]() +OH-
+OH-![]() NH3↑+H2O,当加入200mL氢氧化钡时,气体达到最大,即n(NH4+)=n(NH3)=8.96/22.4mol=0.4mol;(2)根据关系图,当加入100mL氢氧化钡溶液时,沉淀达到最大,即SO42-全部转化成BaSO4沉淀,即溶液中n(SO42-)=23.3/233mol=0.1mol,根据溶液显电中性,即n(NH4+)=2n(SO42-)+n(NO3-),则n(NO3-)=(0.4-2×0.1)mol=0.2mol;(3)根据(1)和(2)的分析,100mL到200mL之间发生的离子反应是NH
NH3↑+H2O,当加入200mL氢氧化钡时,气体达到最大,即n(NH4+)=n(NH3)=8.96/22.4mol=0.4mol;(2)根据关系图,当加入100mL氢氧化钡溶液时,沉淀达到最大,即SO42-全部转化成BaSO4沉淀,即溶液中n(SO42-)=23.3/233mol=0.1mol,根据溶液显电中性,即n(NH4+)=2n(SO42-)+n(NO3-),则n(NO3-)=(0.4-2×0.1)mol=0.2mol;(3)根据(1)和(2)的分析,100mL到200mL之间发生的离子反应是NH![]() +OH-
+OH-![]() NH3↑+H2O。
NH3↑+H2O。

【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:
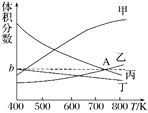
曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。