题目内容
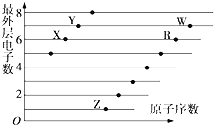
【题目】主族元素X、Y、Z、M、N的原子序数依次增大,X、Z和M分属于不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子。
(1)五种元素中第一电离能最小的是________,电负性最大的是________。(填元素符号)
(2)Y元素原子的价层电子的电子排布图为________,该元素的名称是________。气态分子YM2的立体构型为________,YM2可形成多聚体(YM2)n的原因是________________。
(3)Z和N形成分子W的结构如图所示,化合物W的分子式为________,Z、N原子的杂化类型分别为________、________。

(4)已知化合物NX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成W,此反应是检验微量NX3的方法,该反应的化学方程式是________________________________________________________________________。
(5)画出配离子YZ4X![]() 的结构式:________,1 mol该离子中含有的共价键数目为__________。
的结构式:________,1 mol该离子中含有的共价键数目为__________。
【答案】 Be O ![]() 铍 直线形 BeCl2分子中Be与另外两个 BeCl2分子的Cl原子形成配位键 As4O6 sp3 sp3 4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3
铍 直线形 BeCl2分子中Be与另外两个 BeCl2分子的Cl原子形成配位键 As4O6 sp3 sp3 4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3 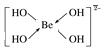 8NA
8NA
【解析】试题分析:主族元素X、Y、Z、M、N的原子序数依次增大,X、Z和M分属于不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,则Y只有2个能层且每个能层都有2个电子,所以Y为铍元素、X为氢元素;Z原子最外层电子数是次外层的3倍,则Z为氧元素、M为氯元素;N元素原子的4p轨道上有3个未成对电子,则N的价电子排布为4s24p3,N为砷元素。
(1)五种元素中,Be是唯一的一种金属,所以第一电离能最小的是Be。电负性最大的是O元素。
(2)Be元素原子的价层电子的电子排布图为![]() ,该元素的名称是铍。气态分子BeCl2的中心原子是铍,铍原子采用sp杂化轨道与2个氯原子成键,所以其立体构型为直线形。BeCl2分子中,铍原子核外有空轨道,氯原子有孤电子对,因此,BeCl2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键。
,该元素的名称是铍。气态分子BeCl2的中心原子是铍,铍原子采用sp杂化轨道与2个氯原子成键,所以其立体构型为直线形。BeCl2分子中,铍原子核外有空轨道,氯原子有孤电子对,因此,BeCl2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键。
(3)由O和As形成分子W的结构示意图以及两种元素的常见化合价(O的常见化合价为-2,As位于第VA族,故其常见化合价为-3、+3、+5)可知,化合物W的分子式为As4O6。在As4O6分子中,每个O原子有两个孤电子对、形成2个σ键,每个As原子有一个孤电子对、形成3外σ键,所以O、As的价层电子对数都是4,因此,O、As原子的杂化类型分别为sp3、sp3。
(4)已知化合物AsH3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成As4O6,此反应是检验微量AsH3的方法,该反应的化学方程式是4AsH3+24AgNO3+6H2O===As4O6+24Ag↓+24HNO3。
(5)配离子BeO4H![]() 就是Be(OH)42-,其中有2个配位键,配位原子为O原子,结构式为
就是Be(OH)42-,其中有2个配位键,配位原子为O原子,结构式为 ,1 mol该离子中含有的共价键数目为8NA。
,1 mol该离子中含有的共价键数目为8NA。

 阅读快车系列答案
阅读快车系列答案