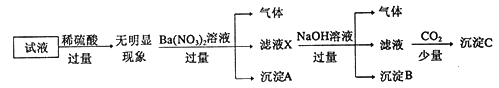
题目内容
【题目】根据问题填空:
(1)已知下列两个热化学方程式: C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2220.0kJmol﹣1
H2O(l)=H2O(g)△H=+44.0kJmol﹣1则0.5mol C3H8燃烧生成CO2和气态水时释放的热量为kJ.
(2)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN﹣N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= . (填﹣724kJmol﹣1或+724kJmol﹣1) 
【答案】
(1)1022
(2)CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJ?mol﹣1
(3)﹣724kJ mol﹣1
【解析】解:(1)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJmol﹣1
②H2O(l)═H2O(g)△H=+44.0kJmol﹣1
根据盖斯定律①+②×4可得丙烷燃烧生成CO2和气态水的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=﹣2220.0kJmol﹣1+4×44.0kJmol﹣1=2044kJmol﹣1,
所以0.5mol丙烷燃烧生成CO2和气态水时释放的热量为:2044kJ/mol×0.5mol=1022kJ,
所以答案是:1022;(2)①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
依据盖斯定律②﹣①得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;
所以答案是:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;(3)从结构图中可看出,一个N4分子中含有6个N﹣N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJmol﹣1﹣2×941 kJmol﹣1=﹣724 kJmol﹣1,
所以答案是:﹣724kJ mol﹣1.

【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
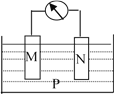
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
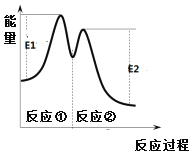
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0