��Ŀ����
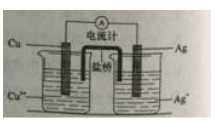
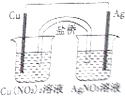
����Ŀ����ͭ��CuFeS2����ұ��ͭ���Ʊ������������Ҫ��أ��������Ľ����ȣ���ͼ���Ի�ͭ��Ϊ��Ҫԭ������ͭ�����죨�����������ϵĹ�������ͼ�� 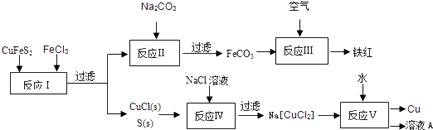
��1��CuFeS2�У�Fe�Ļ��ϼ�Ϊ ��
��2��д������Ӧ�����ӷ���ʽ �� �÷�Ӧ���������� ��
��3��CuCl������ˮ�������������Cl����Ӧ��������ˮ��[CuCl2]�� �� �÷�Ӧ�����ӷ���ʽΪ ��
��4����Ӧ��V�����Ӧ�����ڷ�������ԭ��Ӧ���Ƿ�Ӧ��ѡ���V������
��5����֪Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu���ɴ˿���֪����ҺA���е�����Ϊ��д����ѧʽ����
��6�������ԡ����������£�һ�ֽ�Thibacillus ferroxidans��ϸ���ܽ���ͭ��ת���������Σ��ù��̷�Ӧ�����ӷ���ʽΪ
��7����һ��������������160mL 5molL��1�����У��ټ����������ۣ�����Ӧ�������ռ�������2.24L����״�������������Һ����Fe3+ �� ��μӷ�Ӧ�����۵�����Ϊ ��
���𰸡�
��1��+2
��2��CuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����CuFeS2��FeCl3
��3��Cl��+CuCl=[CuCl2]��
��4��II��I
��5��CuCl2��NaCl
��6��4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O
��7��11.2g
���������⣺�Ȼ������������ԣ���������ͭ���ݲ���֪��ӦIΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����Ȼ����˵õ�����CuCl��S����Һ������Һ�м���̼���Ʒ�����ӦII�����������ӷ�Ӧ����ʽΪFe2++CO32��=FeCO3�������˵õ�FeCO3 �� �ڿ���������FeCO3�õ�����������ӦIIIΪ4FeCO3+O2 ![]() 2Fe2O3+4CO2����CuCl��S�Ļ�����м���NaCl��Һ��������ӦIVΪCl��+CuCl=[CuCl2]�� �� ���˵õ�Na[CuCl2]���ټ���ˮ������ӦV����Cu����ҺA��Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu����AΪCuCl2��NaCl����1��CuFeS2��SΪ��2�ۡ�CuΪ+2�ۣ�Fe�Ļ��ϼ�Ϊ+2�ۣ����Դ��ǣ�+2����2����ӦI�����ӷ���ʽΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S�����÷�Ӧ��FeCl3��CuFeS2���õ��ӣ�����CuFeS2��FeCl3������������
2Fe2O3+4CO2����CuCl��S�Ļ�����м���NaCl��Һ��������ӦIVΪCl��+CuCl=[CuCl2]�� �� ���˵õ�Na[CuCl2]���ټ���ˮ������ӦV����Cu����ҺA��Cu+�ڷ�ӦV�з�������������ԭ��Ӧ���绯ΪC u2+��Cu����AΪCuCl2��NaCl����1��CuFeS2��SΪ��2�ۡ�CuΪ+2�ۣ�Fe�Ļ��ϼ�Ϊ+2�ۣ����Դ��ǣ�+2����2����ӦI�����ӷ���ʽΪCuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S�����÷�Ӧ��FeCl3��CuFeS2���õ��ӣ�����CuFeS2��FeCl3������������
���Դ��ǣ�CuFeS2+3Fe3++Cl��=4Fe2++CuCl��+2S����CuFeS2��FeCl3����3���÷�Ӧ���ӷ���ʽΪCl��+CuCl=[CuCl2]�� �� ���Դ��ǣ�Cl��+CuCl=[CuCl2]������4����Щ��Ӧ��ֻ��II��IVΪ��������ԭ��Ӧ�����Դ��ǣ�������5����Ӧ��ΪNa[CuCl2]��H2O�ķ�Ӧ�����������Ϣ֪��������Cu��NaCl��CuCl2 �� ���õ���Һ�е�������CuCl2��NaCl�����Դ��ǣ�CuCl2��NaCl����6����������Һ�������������Խ���ͭ�������������Σ���Ӧ������μӷ�Ӧ������������ͭ����������ˮ����Ӧ�ķ���ʽΪ4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O�����ӷ�Ӧ����ʽΪ��4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O��
���Դ��ǣ�4CuFeS2+4H++17O2=4Cu2++4Fe3++8SO42��+2H2O����7�����������ʵ���Ϊ ![]() =0.1mol��
=0.1mol��
Fe��������2HCl������H2 ��
0.1mol 0.2mol 0.1mol
������ԭ���غ㣬�����Ȼ��������ʵ���Ϊ ![]() ����0.16L��5mol/L��0.2mol��=0.2mol��
����0.16L��5mol/L��0.2mol��=0.2mol��
Fe������2FeCl3
0.1mol 0.2mol
���Բμӷ�Ӧ�����۵�����Ϊ��0.1mol+0.1mol����56g/mol=11.2g��
���Դ��ǣ�11.2g��

 �Ķ��쳵ϵ�д�
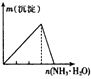
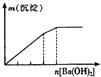
�Ķ��쳵ϵ�д�����Ŀ������ʵ�����Ӧʾ��ͼ�Ĺ�ϵ��ȷ���ǣ� ��
A | B | C | D |
NaAlO2��Һ����εμ����������� | AlCl3��Һ����εμӰ�ˮ������ | ������Һ����εμ�Ba��OH��2��Һ������ | ����ʯ��ˮ�л���ͨ��CO2������ |
|
|
|
|
A.A
B.B
C.C
D.D