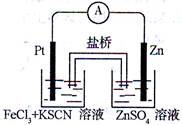
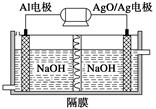
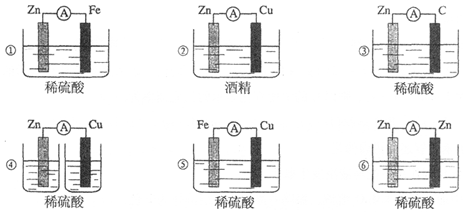
题目内容
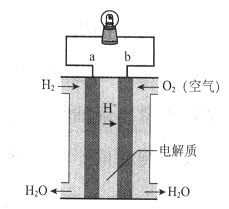
某同学设计在KOH溶液中用铂作电极,利用CH3OH和O2的反应来构成原电池。下列说法正确的是( ):①正极上O2得到电子,发生还原反应②每消耗1molCH3OH可以向外电路提供6mole-③该电池的总反应为:2CH3OH+3O2=2CO2+4H2O④电池放电后,溶液的pH不断升高
| A.①② | B.①③ | C.②③ | D.③④ |
A
试题分析:利用CH3OH和O2的反应制成燃料电池,在电池反应中O2 作氧化剂,得电子发生还原反应,应该做电池正极,所以①正确;在反应中每消耗1molCH3OH反应1.5mol的O2 ,所以转移电子6mol,②正确;CH3OH和O2 反应是在碱性介质中进行的,所以生成的CO2 会与碱反应,反应式应该为2CH3OH+3O2 +4KOH=2K2CO3+6H2O,所以③错误;随着反应的进行,KOH逐渐被消耗,所以溶液的pH值不断下降,④错误;只有①②正确,故选A。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目

 ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )