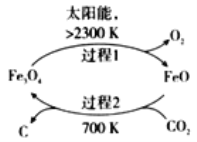
题目内容
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A:_______,B:_______,C:________。
(2)D2A的电子式___________,
(3)D2A2的化学式__________,灼烧该化合物火焰呈_________色。
(4)C在元素周期表中的位置是_________,其原子结构示意图为_________________。
(5)比较A、B简单氢化物的沸点________;原因_____________________________。
【答案】O C Si ![]() Na2O2 黄色 第三周期IVA族
Na2O2 黄色 第三周期IVA族  H2O > CH4 水分子间形成氢键,加大了分子间作用力
H2O > CH4 水分子间形成氢键,加大了分子间作用力
【解析】
A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na,据此解答。
(1)由上述分析可知,A为O,B为C,C为Si,故答案为:O;C;Si;
(2)D2A为Na2O,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)D2A2的化学式为Na2O2,灼烧该化合物火焰呈黄色,故答案为:Na2O2;黄色;
(4)C为Si,元素周期表中的位置是第三周期IVA族,原子结构示意图为 ,故答案为:第三周期IVA族;
,故答案为:第三周期IVA族; ;
;
(5)A为O元素,B为C元素,A、B简单氢化物分别为H2O、CH4,由于水分子间形成氢键,加大了分子间作用力,所以沸点H2O>CH4,故答案为:H2O>CH4;水分子间形成氢键,加大了分子间作用力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06