题目内容
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的
实验装置。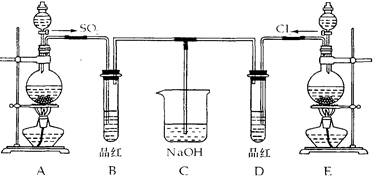
(1)实验室用装置A制备SO2某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未
流下,你认为原因可能是:
(2)实验室用装置E制备Cl2其反应的化学化学方程式为:MnO2+4HCl(浓)=C12↑+MnCl2+2H2O
浓盐酸的作用为:
(3)反应开始一段时间后,观察到 B、D两个试管中的品红溶液出现的现象是:
B: D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B: D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性.二者混合后的漂白性肯定会更强。他们将制得的SO2和CI2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(1)分液漏斗的玻璃塞没有取下来(2分)
(2)酸性(1分),还原剂 (1分)
(3)①品红褪色(1分) 品红褪色(1分)
②褪色的品红又恢复成红色(1分) 溶液没有恢复成红色(1分)
(4)Cl2+SO2+2H2O=2HCl+H2SO4 (2分)
解析试题分析:(1)打开A的分液漏斗活塞后,漏斗中液体未流下,可能原因是分液漏斗的玻璃塞没有取下来,
(2)浓盐酸与二氧化锰反应除了被氧化成氯气外还生成铝盐和水,所以浓盐酸的作用为酸性、还原剂
(3)①二氧化硫具有漂白作用,能使品红褪色,所以B中品红褪色;氯气与水反应生成的次氯酸具有强氧化性,可以氧化品红使品红褪色,所以D中品红也褪色
②二氧化硫的漂白使品红褪色是暂时的,加热后品红又变成红色,而次氯酸使品红褪色是永久的,加热也不恢复,所以D中溶液没有恢复成红色
(4)氯水与二氧化硫混合会发生氧化还原反应彼此都失去了漂白作用,化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4
考点:考查二氧化硫与氯水的漂白作用的区别

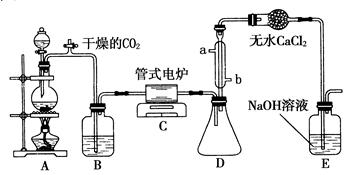
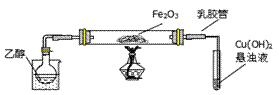
某研究性学习小组为测定NH3分子中氮、氢原子个数比,设计如下实验流程:
实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。
下图A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
请回答下列问题:
(1)写出仪器的名称:a ,b 。
(2)硬质玻璃管中发生的反应方程式是 ,反应过程中硬质玻璃管的现象是 。
(3)请判断制取氨气可能用到的装置,在下表中你认为可行的装置中填写对应的实验药品(写出化学式)。
| 装置 | 实验药品 |
| A | |
| B | b: a: |
| C | c: 隔板: |
(4)实验时洗气瓶D中的浓硫酸表现 性;该小组实验测得:洗气前装置D的质量为m1g、洗气后装置D的质量为m2g、生成的氮气在标准状况下的体积为V L。根据该小组计算NH3分子中氮、氢的原子个数比的表达式,请预计该结果与理论值相比, 。
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙工艺流程为: 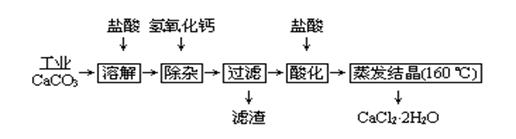
已知:查阅资料得知氢氧化物沉淀时的pH为:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(1)CaCO3与盐酸反应的离子方程式 。
(2)除杂操作是加入氢氧化钙,调节溶液的pH为 ,目的是除去溶液中少量的Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
。
(3)过滤时需用的玻璃仪器有 。滤渣主要成分的化学式 。
(4)酸化时加盐酸的目的为:① ,②防止Ca2+ 在蒸发时发生水解。
(5)为什么蒸发结晶要保持在160℃: 。
(6)测定晶体样品的纯度:若用一定浓度的AgNO3溶液滴定一定质量的晶体样品,所测样品中CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是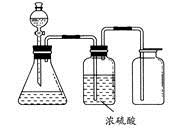
| A.铜屑和稀硝酸 |
| B.二氧化锰和浓盐酸 |
| C.用浓氨水和生石灰反应 |
| D.碳酸钙和稀盐酸 |
 =_____。
=_____。