题目内容
【题目】黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
Ⅰ. 探究KO2与水的反应:取少量KO2固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加FeCl3溶液,产生的现象为____________________________________。
Ⅱ. 探究KO2与SO2的反应:
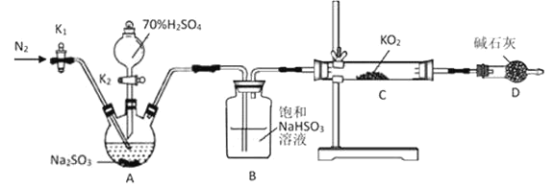
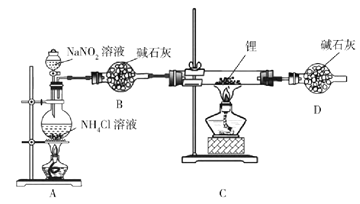
(1)正确的操作依次是_________________________。(操作可重复选择)
①打开K1通入N2,并维持一段时间后关闭
②实验完成,拆卸装置
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(2)A装置发生反应的化学方程式为________________________。
(3)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是________。
(4)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,得沉淀4.66g。
②将N溶液移入锥形瓶中,用0.20mol ![]() L-1酸性KMnO4溶液滴定,当出现___________现象时,达到滴定终点,此时消耗酸性KMnO4溶液20.00mL。
L-1酸性KMnO4溶液滴定,当出现___________现象时,达到滴定终点,此时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出装置C中总反应的化学方程式___________。
【答案】有红褐色沉淀和气泡产生 ③①④①② ![]() 在B、C之间连接一个盛有浓硫酸的洗气瓶 滴下最后一滴KMnO4溶液,锥形瓶中溶液由无色变为微红色,且半分钟(30s)内不褪色 12KO2+6SO2=2K2SO3+4K2SO4+7O2
在B、C之间连接一个盛有浓硫酸的洗气瓶 滴下最后一滴KMnO4溶液,锥形瓶中溶液由无色变为微红色,且半分钟(30s)内不褪色 12KO2+6SO2=2K2SO3+4K2SO4+7O2
【解析】
黄色超氧化钾(KO2)与水反应生成KOH溶液和放出大量氧气,实验探究KO2与SO2的反应,先排除装置内空气,再反应生成二氧化硫,二氧化硫和KO2反应,根据实验探究生成的产物进行实验分析,再根据得到硫酸钾和亚硫酸钾的物质的量书写方程式。
Ⅰ. 探究KO2与水的反应:取少量KO2固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。溶液中含有大量的KOH溶液和H2O2溶液,向褪色后溶液中滴加FeCl3溶液,因此产生的现象为有红褐色沉淀和气泡产生;故答案为:红褐色沉淀和气泡产生。
Ⅱ(1)先检查装置气密性,然后装入药品,再打开K1通入N2,并维持一段时间,排除装置内空气后关闭,再打开分液漏斗活塞K2,产生二氧化硫气体,KO2与SO2反应,再打开K1通入N2,并维持一段时间,将生成的SO2全部排除后关闭,实验完成,拆卸装置,因此正确的操作依次是③①④①②;故答案为:③①④①②。
(2)A装置是浓硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应的化学方程式为![]() ;故答案为:
;故答案为:![]() 。
。
(3)用上述装置验证“KO2与SO2反应生成O2”还存在不足,由于二氧化硫通入到饱和亚硫酸氢钠溶液中带出了水,水可能与KO2反应生成O2,因此改进措施是在B、C之间连接一个盛有浓硫酸的洗气瓶;故答案为:在B、C之间连接一个盛有浓硫酸的洗气瓶。
(4)②将N溶液移入锥形瓶中,用0.20 molL1酸性KMnO4溶液滴定,当出现滴下最后一滴KMnO4溶液,锥形瓶中溶液由无色变为微红色,且半分钟(30s)内不褪色的现象,达到滴定终点;故答案为:滴下最后一滴KMnO4溶液,锥形瓶中溶液由无色变为微红色,且半分钟(30s)内不褪色。
③向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,得BaSO4沉淀4.66g即物质的量为0.02mol。N中亚硫酸和高锰酸钾溶液反应,根据5![]() ~2
~2![]() ,n(
,n(![]() )=2.5×0.20 molL1×0.02L =0.01mol,生成的K2SO4和K2SO3物质的量之比为2:1,请写出装置C中总反应的化学方程式12KO2+6SO2=2K2SO3+4K2SO4+7O2;故答案为:12KO2+6SO2=2K2SO3+4K2SO4+7O2。
)=2.5×0.20 molL1×0.02L =0.01mol,生成的K2SO4和K2SO3物质的量之比为2:1,请写出装置C中总反应的化学方程式12KO2+6SO2=2K2SO3+4K2SO4+7O2;故答案为:12KO2+6SO2=2K2SO3+4K2SO4+7O2。