题目内容
下列物质中,属于强电解质的是( )
| A、Fe | B、CO2 | C、CH3COOH | D、H2SO4 |
分析:电解质是指溶于水溶液中或在熔融状态下就能够导电的化合物;在水溶液里或熔融状态下能完全电离的化合物为强电解质;在水溶液里或熔融状态下能部分电离的化合物为弱电解质;在水溶液里或熔融状态下都不导电的化合物是非电解质;单质和混合物既不是电解质也不是非电解质,据此分析解答.
解答:解:A.铁是单质,不是化合物,所以不属于电解质,故A错误;
B.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故B错误;
C.乙酸在水溶液中能部分电离CH3COOH?CH3COO-+H+,是弱电解质,故C错误;
D.硫酸在水溶液中能完全电离,H2SO4=2H++SO42-,是强电解质,故D正确.
故选D.
B.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故B错误;
C.乙酸在水溶液中能部分电离CH3COOH?CH3COO-+H+,是弱电解质,故C错误;
D.硫酸在水溶液中能完全电离,H2SO4=2H++SO42-,是强电解质,故D正确.
故选D.
点评:本题主要考查了强电解质的判别,掌握强电解质的特征完全电离是解答的关键,题目难度不大.

练习册系列答案
相关题目
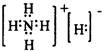


 (5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。
(5)B2D42-和 (分子)是等电子体,B2D42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色(还原产物为Mn2+),写出变化的离子方程式: 。