题目内容
7.下列关于元素周期表和元素周期律的说法不正确的是( )| A. | 碱性:LiOH>NaOH>KOH | |
| B. | 熔点:I2>Br2>Cl2 | |
| C. | 热稳定性:HF>HCl>HBr | |
| D. | 若X2-的核外电子数目为18,则元素X在第三周期ⅥA族 |
分析 A、元素金属性越强,最高价氧化物对应水化物的碱性越强.同主族自上而下,元素的金属性增强;
B、分子晶体相对分子量越大,熔点越高;
C、非金属性越强对应氢化物越稳定;
D、原子得电子形成阴离子,阴离子的核外电子数=质子数+所带电荷数,确定质子数,判断在周期表中位置.
解答 解:A、同主族自上而下,元素的金属性增强,故金属性K>Na>Li,元素金属性越强,最高价氧化物对应水化物的碱性越强,故碱性KOH>NaOH>LiOH,故A错误;
B、分子晶体相对分子量越大,熔点越高,所以熔点:I2>Br2>Cl2,故B正确;
C、非金属性F>Cl>Br,所以稳定性:HF>HCl>HBr,故C正确;
D、X2-的核外电子数目为18,所以质子数为18-2=16,为S元素,位于第三周期第ⅥA族,故D正确;
故选A.
点评 本题考查同周期、同主族元素性质的递变规律、元素周期律等,难度不大,注意元素周期律的掌握.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
8.下列实验现象,与新制氯水中的某些成份(括号内物质)没有关系的是( )
| A. | 将NaHCO3 固体加入新制氯水,有无色气泡(H+ ) | |
| B. | 滴加AgNO3 溶液生成白色沉淀(Cl- ) | |
| C. | 向FeCl2 溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2 ) | |
| D. | 使红色面条褪色(HCl) |
9.实验室制备Al(OH)3最好用( )
| A. | Al和水 | B. | Al2O3和水 | C. | Al2(SO4)3和KOH | D. | AlCl3和氨水 |
15.下列关于同系物说法中正确的是( )
| A. | 符合同一通式的物质一定属于同系物 | |
| B. | 同系物的碳元素的质量分数一定相等 | |
| C. | 随碳原子数增加,烷烃的熔沸点逐渐升高 | |
| D. | 乙醇和HOCH2CH2CH2OH是同系物 |
2.下列有机物的命名正确的是( )
| A. |  2-乙基丙烷 | B. | 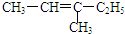 3-甲基-3-戊烯 | C. | 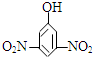 2,4-二硝基苯酚 | D. | 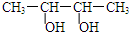 2,3-丁二醇 |
12.做化学实验时,发生下列事故,处理方法不正确的是( )
| A. | 金属钠着火,用泡沫灭火器扑灭 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 皮肤溅上浓HNO3,立即用大量水冲洗,再用小苏打水洗涤 | |
| D. | 汞洒落地面,应立即用硫粉覆盖 |
16.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-═14OH-. 有关此电池的推断错误的是( )
| A. | 此燃料电池工作时,电解质溶液中的OH-向负极移动 | |
| B. | .参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | .电池工作一段时间后,KOH的物质的量浓度将下降 | |
| D. | .通氧气的电极为负极 |
 将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答:
将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答: