题目内容
【题目】将一定量氨基甲酸铵![]() 加入密闭容器中,发生反应
加入密闭容器中,发生反应![]() 。该反应的平衡常数的负对数
。该反应的平衡常数的负对数![]() K
K![]() 值随温度
值随温度![]() T
T![]() 的变化曲线如图所示,下列说法错误的是
的变化曲线如图所示,下列说法错误的是
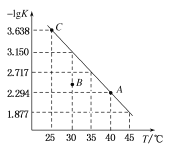
A.C点对应状态的平衡常数 K( C )![]()
B.该反应的![]() H
H ![]()
C.![]() 的体积分数不变时,该反应一定达到平衡状态
的体积分数不变时,该反应一定达到平衡状态
D.30℃时, B点对应状态的 v![]() 正
正![]() v
v![]() 逆
逆![]()
【答案】C
【解析】
A. C点![]() ,则平衡常数
,则平衡常数![]() ,故A正确;
,故A正确;
B. ![]() 越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,故该反应的
越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,故该反应的![]() ,故B正确;
,故B正确;
C. 反应得到![]() 、
、![]() 的物质的量之比为2:1,反应开始后氨气体积分数始终不变,
的物质的量之比为2:1,反应开始后氨气体积分数始终不变,![]() 的体积分数不变不能说明该反应达到平衡状态,故C错误;
的体积分数不变不能说明该反应达到平衡状态,故C错误;
D. B点浓度商大于平衡常数,反应向逆反应进行,则B点对应状态的![]() 正
正![]() 逆
逆![]() ,故D正确。
,故D正确。
故选C。

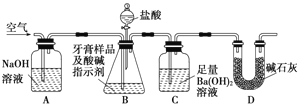
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:

请你帮助该同学整理并完成实验报告:
(1)实验目的:_______________。
(2)实验用品:
仪器:________________;药品:__________。
(3)实验内容:(填写题给信息表中的序号)_____
实验方案 | 实验现象 | 有关化学方程式 |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
(4)实验结论:____________。
(5)请用物质结构理论简单说明具有上述结论的原因。__________
(6)请你补充两组简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。_________