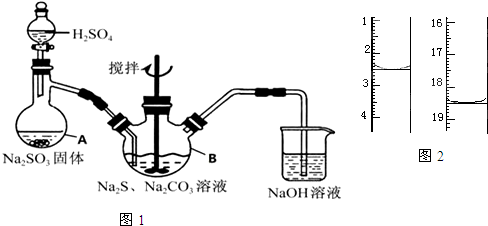
题目内容
14. 在2L恒容密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L恒容密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用氧气表示0-2s内该反应平均反应速率v(O2)=1.5×10-3mol•L-1•s-1.
(3)求达平衡时NO的转化率为65%.
(4)能说明该反应已经达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是b.
a.及时分离出NO2气体 b.增大O2的浓度.c.适当升高温度 d.使用高效催化剂.
分析 (1)平衡常数指:一定温度下,可逆反应到达平衡,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积之比;
温度越高,平衡常数越小,说明升高温度平衡逆向移动,正反应为放热反应;
升高温度,正逆速率都增大;
由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,属于可逆反应,3s时反应达平衡,5s时消耗的NO为0.02mol-0.007mol=0.013mol,进而计算NO转化率;
(2)NO2是产物,随反应进行浓度增大,平衡时△c(NO2)=△c(NO);
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)平衡时NO的转化率=$\frac{反应的NO物质的量}{NO起始物质的量}$×100%;
(4)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,判断平衡的物理量随反应进行发生变化,该物理量由变化到不再变化,说明到达平衡;
(5)a.及时分离出NO2气体,生成物浓度降低,反应速率减小;
b.增大反应物O2的浓度,反应速率增大,平衡正向移动;
c.适当升高温度,平衡逆向移动;
d.使用高效催化剂不影响平衡移动.
解答 解:(1)2NO(g)+O2(g)?2NO2(g)的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;
温度越高,平衡常数越小,说明升高温度平衡逆向移动,正反应为放热反应;
升高温度,正、逆反应速率都增大,
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;放热;增大;
(2)NO2是产物,随反应进行浓度增大,平衡时△c(NO2)=△c(NO)=$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{0.02mol-0.008mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,平衡时消耗的NO为0.02mol-0.007mol=0.013mol,平衡时NO转化率为$\frac{0.013mol}{0.02mol}$×100%=65%,
故答案为:65%;
(4)a.表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,若分别为正、逆速率,等于化学计量数之比,反应到达平衡,故a错误;
b.随反应进行,反应混合气体总的物质的量在减小,压强减小,压强保持保持不变,说明反应到达平衡,故b正确;
c.不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(NO):v正(O2)=2:1,即v逆(NO)=2v正(O2),故c正确;
d.混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故选:bc;
(5)a.及时分离出NO2气体,平衡正向移动,但生成物浓度降低,反应速率减小,故a错误;
b.增大反应物O2的浓度,反应速率增大,平衡正向移动,故b正确;
c.适当升高温度,反应速率加快,但平衡逆向移动,故c错误
d.使用高效催化剂可以加快反应速率,但不影响平衡移动,故d错误,
故选:b.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、反应速率计算等,注意判断平衡的物理量随反应进行发生变化,该物理量由变化到不再变化,说明到达平衡,注意对基础知识的理解掌握,难度中等.

| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.04mol/L | D. | 0.4mol/L |
| A. | 稀氨水和酚酞溶液 | B. | 滴有酚酞的Na2CO3溶液 | ||
| C. | 滴有酚酞的氢氧化钙溶液 | D. | 溶有SO2的品红溶液 |
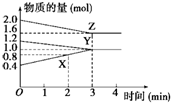 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示,由图中数据分析: