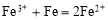题目内容
(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。 现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是_______。
②写出一个包含上述七种物质的氧化还原反应方程式(不需配平) ___________。
③上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:___________________________________________________________________。
(2)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
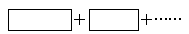
反应中,被还原的元素是________,氧化产物是______________。
②纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为________。
(3)一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗3.2 g CH3OH转移0.6 mol电子,则氧化产物为(填化学式),氧化产物与还原产物的物质的量之比是________。
(1)①KCl H2SO4
②KMnO4+KCl+H2SO4―→K2SO4+MnSO4+Cl2↑+H2O
③KMnO4 得到 5
④NaBiO3具有强氧化性(比KMnO4氧化性强)
(2)①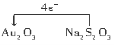 Au Na2S4O6 ②1∶4
Au Na2S4O6 ②1∶4
(3)CO2. 5:3
【解析】
试题分析:(1)将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则反应物为HCl、KMnO4,且还原剂为HCl,氧化剂为KMnO4;则氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4。
①该反应中Cl元素的化合价升高,H、S、O元素的化合价没有变化,则化合价升高的反应物为KCl,化合价没有发生变化的反应物为H2SO4。
②KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O。
③该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子。
(2)①Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,故Na2S2O3转移4e-给Au2O3。被还原的元素是Au,氧化产物是Na2S4O6。
②反应中Na2S2O3→H2SO4,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4
(3)3.2gCH3OH的物质的量为0.1mol,转移0.6mol电子时,化合价变化为6。所以氧化产物为CO2.根据HNO3→N2,由得失电子守恒,则参加反应的HNO3的物质的量为0.12mol,故氧化剂与还原剂的物质的量之比为:0.12:0.1=6:5。氧化产物与还原产物的物质的量之比是0.1:0.06=5:3。
考点:氧化还原反应的计算

 名校课堂系列答案
名校课堂系列答案