��Ŀ����
����Ŀ��(1)�ڱ�״���£����Ϊ11.2L ��SO2����Oԭ����Ϊ__________��
(2)9gˮ��_________g���������ķ�������ȣ�����������ԭ����֮����__________��
(3)��2H2S��SO2===2H2O��3S��Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ__________��
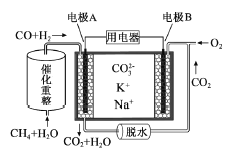
(4)�����ж���ʵ���ҳ���NaOH��Һ���ն������������Ӧ�����ӷ���ʽΪ
______________________________����������CO2ͨ����������Һ�з�����Ӧ�����ӷ���ʽΪ__________________________________________________________________________��
(5) ��ƽ���л�ѧ����ʽ___NH3 + ___O2 === ___NO + ___H2O
(6) �������л�ѧ����ʽ����˫���ŷ��������ת�Ƶķ������Ŀ 8NH3 �� 3Cl2 === 6NH4Cl �� N2__________________________________ ��
���𰸡�NA 49 1:4 2:1 Cl2+2OH���TCl��+ClO��+H2O Ca2+ + 2ClO- + H2O + CO2 = CaCO3�� + 2HClO 4 5 4 6 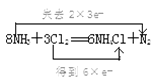
��������
��1������£�����Ħ�������22.4L/mol������������ʵ���=![]() =0.5mol������=0.5mol��64g/mol=32g��������=0.5mol��NA/mol=0.5NA��ÿ�������к�������Oԭ�ӣ���������ԭ�Ӹ���ΪNA��
=0.5mol������=0.5mol��64g/mol=32g��������=0.5mol��NA/mol=0.5NA��ÿ�������к�������Oԭ�ӣ���������ԭ�Ӹ���ΪNA��
��2��n��H2O��=![]() =0.5mol����n=
=0.5mol����n=![]() =
=![]() ��֪��������֮�ȵ������ʵ���֮�ȣ���m��H2SO4��=0.5mol��98g/mol=49g���ɷ�����ɿ�֪������������ԭ����֮����1��4��
��֪��������֮�ȵ������ʵ���֮�ȣ���m��H2SO4��=0.5mol��98g/mol=49g���ɷ�����ɿ�֪������������ԭ����֮����1��4��
��3����SO2+2H2S=2H2O+3S����Ӧ�У�SO2��SԪ�صĻ��ϼ���+4����Ϊ0��Ϊ��������H2S��SԪ�صĻ��ϼ���-2���ߵ�0��Ϊ��ԭ������S���ʼ��������������ǻ�ԭ�����Sԭ���غ㼰��Ӧ��֪��2mol��ԭ����Ӧ������������Ϊ2mol��1mol��������Ӧ���ɻ�ԭ����Ϊ1mol���������������뻹ԭ��������ʵ���֮��Ϊ2mol��1mol=2��1��
��4������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ�����ӷ�Ӧ����ʽΪCl2+2OH=Cl-+ClO-+H2O��
��5����Ԫ�صĻ��ϼ���-3�����ߵ�+2�ۣ�����Ԫ�صĻ��ϼ���0�۽��͵�-2�ۣ����ݵ�ʧ������Ŀ��ȿ�֪��������֮��Ϊ4��5����NO��ϵ����4��������Ԫ���غ��֪ˮΪ6���ʴ�Ϊ��4��5��4��6��
��6��8NH3��3Cl2 =6NH4Cl��N2��Ӧ�У�ClԪ�صĻ��ϼ۴�0�۽��͵�-1�ۣ����õ�6�����ӣ�NԪ�صĻ��ϼ۲��ִ�-3�����ߵ�0�ۣ���ʧȥ6�����ӣ���˫���ű�ʾΪ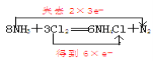 ��
��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�����Ŀ����H2Sת��Ϊ�������õ���Դ����Դ�о��������Ҫ���⡣
��1��H2S��ת��
�� | ����˹�� |
|
�� | ���������� |
|
�� | ��ֽⷨ |
|
�� ��Ӧ��Ļ�ѧ����ʽ��________��
�� ��Ӧ��____+ 1 H2S ==____Fe2+ + ____S�� + ____������Ӧ������������
�� ��Ӧ��������H2S���ȶ�������H2O�����ԭ�ӽṹ���Ͷ����ȶ��Բ����ԭ��_______��
��2����Ӧ����IJ��ʵͣ���Ӧ���ԭ�������ʵ͡��ҹ�������Ա���뽫������Ӧ��ϣ�ʵ����H2S��Ч����S��H2������ת�ƹ�����ͼ��

���̼ס����У��������ֱ���______��
��3��������ƣ�������Ա�о����¡�
�� �����о��������Ƿ���У�װ����ͼ�������飬n����������Fe3+��p��������H2��n��������Fe3+�Ŀ���ԭ��

����Fe2+ - e- = Fe3+
����2H2O -4e-=O2 +4H+��_______��д���ӷ���ʽ������ȷ�ϣ����Dz���Fe3+��ԭ�����ҿ��С�
�� ���ղ���Fe3+����n����ע��H2S��Һ����S���ɣ���������������p������H2���о�S������ԭ���������ʵ�鷽����______�� ��ȷ�ϣ�S����Fe3+����H2S���ã�H2S����ֱ�ӷŵ硣���̼��С�
��4�����ϣ���Ӧ������ϣ�ͬʱ�ܸ�Ч����H2��S���乤��ԭ����ͼ��

��һ���о����֣�����Fe3+/Fe2+ �⣬I3-/I- Ҳ��ʵ����ͼ��ʾѭ�����̡���ϻ�ѧ���˵��I3-/I- �ܹ�ʹSԴԴ���ϲ�����ԭ��________��