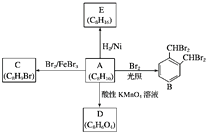
题目内容
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,![]() 减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
【答案】B
【解析】
A. 25℃时,AgBr的Ksp相等,0.01mol/L的MgBr2溶液和NaBr溶液中的c(Br-)不同,因此两种溶液中的c(Ag+)不同,即AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度不同,故A错误;B. NaCN溶液和盐酸混合呈中性的溶液中存在电荷守恒,c(Na+)+ c(H+)=c(OH-)+c(Cl-)+ c(CN-),溶液呈中性,则c(H+)=c(OH-),因此c(Na+)=c(Cl-)+ c(CN-),则c(Na+)>c(Cl-),根据物料守恒,c(Na+)= c(HCN)+ c(CN-),因此c(Cl-)=c(HCN),故B正确;C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,温度不变,电离平衡常数不变,则K=![]() 不变,故C错误;D. Na2CO3、NaHCO3溶液等浓度等体积混合后的溶液中存在物料守恒,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故D错误;故选B。
不变,故C错误;D. Na2CO3、NaHCO3溶液等浓度等体积混合后的溶液中存在物料守恒,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故D错误;故选B。

【题目】某班同学用如下实验探究Fe2+、Fe3+和FeO42-的性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________;将FeCl3晶体溶于浓盐酸,再稀释到需要的浓度,盐酸的作用是________。
(2)制备K2FeO4(夹持装置略)后,取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
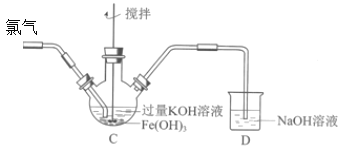
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。根据K2FeO4的制备原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。