��Ŀ����
����Ŀ��ʵ���Ҳⶨ̼���ƺ�̼�����ƻ������̼���Ƶ���������w(Na2CO3)����ȡ�˻����5.0g������ˮ�У����250 mL��Һ��
����һ�������������û�ѧ��Ӧ��HCO3����CO32����ȫת��Ϊ��������������������������ɴ˼���������w(Na2CO3)��
��1����ȡ100 mL���ƺõ���Һ���ձ��У��μ�����������������Һ��HCO3����CO32����ȫת��Ϊ������Ӧѡ�õ��Լ���________(����)��
A.CaCl2��Һ B.MgSO4��Һ C.NaCl��Һ D.Ba(OH)2��Һ
��2�����ˣ���ȡ����������˲�������Ҫ�IJ����������ձ��Ͳ������⣬����_______��
��3��������ϴ�ӣ�����ָ����������������Ϊmg���ɴ˿��Լ���(Na2CO3)������˲��У�����δ�����־ͳ���������w(Na2CO3)_______(����ƫ��������ƫС��������Ӱ����)��
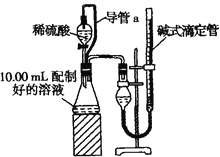
������������������ȡ10.00 mL���ƺõ���Һ������ϡ������Һ��Ӧ���ⶨ����������ͨ��״��(Լ20�桢1.01��105 Pa)��������ɴ˼���������w(Na2CO3)��
��1��װ���е���a��������______________________________, ����ȥ����a��ʹ����������_______(����ƫ��������ƫС��������Ӱ����)��
��2����Ӧ������Ϊ��ȷ�ز�������������������ڶ���ʱӦע�⣺��___________________����_________________________����_______________________��
���������ζ�������ȡ25.00 mL���ƺõ���Һ������ƿ�У��μ�2�η�̪�Լ���ҡ�ȣ���0.2000 mol/L������ζ����յ�(��֪�յ�ʱ��ӦH��+ CO32��![]() HCO3��ǡ����ȫ����ʱ��ҺpH<8)���ظ��˲���2�Σ�������������ƽ��ֵΪ20.00 mL����ȡ25.00 mL���ƺõ���Һ��Ӧѡ���ʽ�ζ�������ɡ�����
HCO3��ǡ����ȫ����ʱ��ҺpH<8)���ظ��˲���2�Σ�������������ƽ��ֵΪ20.00 mL����ȡ25.00 mL���ƺõ���Һ��Ӧѡ���ʽ�ζ�������ɡ�����
��1���жϵζ��յ��������_________________________��
��2���˷����w(Na2CO3)=___________����
���𰸡� D ©�� ƫС ƽ����ѹ��ʹ��Һ˳������ ƫ�� ����ȴ�����²ſ�ʼ���� ����ǰ��������Һ����ƽ �۾�������Һ����ʹ���ƽ ��Һ�ɺ�ɫͻ��Ϊ��ɫ����30s�ڲ��ָ� 84.8%
������������һ:
��1������Һ��HCO3����CO32����ȫת��Ϊ������ѡ��Ba(OH)2��Һ���������·�Ӧ��HCO3��+Ba2++OH��=BaCO3 ��+ H2O��CO32��+Ba2+=BaCO3 ����
��2�����ˣ���ȡ����������˲�������Ҫ�IJ����������ձ�����������©����
��3����̼����Ϊxmol��̼������Ϊymol����������Ϊag���������غ㡢̼Ԫ���غ�ã�106g/molx+84g/moly=5g��x+y=ag/197g/mol����ã�x=(5-84a/197)g������δ�����־ͳ�����aֵƫ����x��ֵƫС��
������
��1����ƿ�м������������壬ѹǿ�����������ƽ��μӣ�Ϊ��ʹ��Һ©������ƿ��ѹǿ��ȣ��������ֺ�ѹװ�á���������ƽ����ѹ��ʹ��Һ˳����������ѹʱ����Һ©������ƿ��ѹǿ��ȣ��������������Ƿ�Ӧ������������������ȥ����a������������������Һ������뷴Ӧ��������������������ɣ��ʳ�ȥ����aʱ����������ƫ��
��2����Ӧ������Ҫȷ�ز�������������ⳣ�³�ѹ����������壬�������ڡ���ѹǿ��ȣ���ˣ�Ҫ�ȴ�������ȴ�����²ſ�ʼ����������ǰ��������Һ����ƽ���۾�������Һ����ʹ���ƽ��
������
��������ȡ25.00 mL���ƺõ���Һ������ƿ�У��μ�2�η�̪�Լ���ҡ�ȣ���0.2000 mol/L������ζ����յ�(��֪�յ�ʱ��ӦH��+ CO32��![]() HCO3��ǡ����ȫ����ʱ��ҺpH<8)���ظ��˲���2�Σ�������������ƽ��ֵΪ20.00 mL����ȡ25.00 mL���ƺõ���Һ��Ӧѡ���ʽ�ζ�������ɡ�����
HCO3��ǡ����ȫ����ʱ��ҺpH<8)���ظ��˲���2�Σ�������������ƽ��ֵΪ20.00 mL����ȡ25.00 mL���ƺõ���Һ��Ӧѡ���ʽ�ζ�������ɡ�����
��1���ζ��յ��������NaHCO3����Һ��pH<8����ζ��յ����������Һ�ɺ�ɫͻ��Ϊ��ɫ����30s�ڲ��ָ���
��2�� �� H��+ CO32��![]() HCO3����֪��
HCO3����֪��
n(HCl)=n(Na2CO3)=0.2000 mol/L��0.02L=0.004000mol��
ԭ��Һ��n(Na2CO3)= 0.004000mol��250mL/25mL=0.04000mol��
w(Na2CO3)= (0.04000mol��106g/mol)��5.0g= 84.8%��

 ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�