题目内容
【题目】中国科学院研究员马大为以氨基酸铜的络合物为催化剂实现了碳![]() 氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
氮键的高效构筑,为含苯胺片段的药物及材料的合成提供了一种简便、实用的方法,马大为借助这一研究也获得了“未来科学大奖物质科学奖”。如图是一种氨基酸铜的络合物的结构简式。
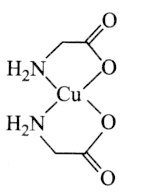
回答下列问题:
![]() 基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有
基态铜原子的最外层电子所处的原子轨道的形状为________,某同学查阅资料发现铜有![]() 价,则基态
价,则基态![]() 的价电子轨道表达式为________。
的价电子轨道表达式为________。
![]() 、C、N、O四种元素的第一电离能由大到小的顺序为________
、C、N、O四种元素的第一电离能由大到小的顺序为________![]() 用元素符号表示
用元素符号表示![]() ;该氨基酸铜中碳原子的杂化方式为________;
;该氨基酸铜中碳原子的杂化方式为________;![]() 氨基酸铜中含有________
氨基酸铜中含有________![]() 键。
键。
![]() 、O元素可形成多种微粒,
、O元素可形成多种微粒,![]() 的空间构型为________,写出一种与
的空间构型为________,写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
![]() 铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
铜晶体是面心立方结构,铜晶体的空间利用率为________;配位数为________。
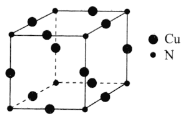
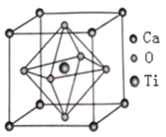
![]() 铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,
铜元素与氮元素形成的一种晶体的立方晶胞如图所示,该晶体的化学式为________,两个最近的氮原子之间的距离为anm,![]() 表示阿伏加德罗常数的值,则该晶体的密度为________
表示阿伏加德罗常数的值,则该晶体的密度为________![]() 用含a、
用含a、![]() 的代数式表示
的代数式表示![]() 。
。
【答案】球形 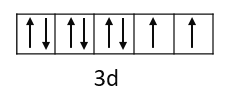
![]()
![]() 、
、![]() 2 正四面体形
2 正四面体形 ![]()
![]() 12
12 ![]()
![]()
【解析】
![]() 为29号元素,基态Cu原子电子排布式为1s22s22p63s23p63d104s1;
为29号元素,基态Cu原子电子排布式为1s22s22p63s23p63d104s1;
(2)C、N、O为同周期主族元素,第一电离能随核电荷数增大呈增大趋势,但N的2p轨道为半充满结构,相对稳定;
![]() 中N的杂化轨道数
中N的杂化轨道数![]() ,采用
,采用![]() 杂化;
杂化;
![]() 铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足
铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足![]() ,求得
,求得![]() ,据此计算空间利用率
,据此计算空间利用率 ;
;
![]() 每个晶胞含有Cu:
每个晶胞含有Cu:![]() ,含有N:
,含有N:![]() ,故晶体的化学式为
,故晶体的化学式为![]() ,每个晶胞的质量
,每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,再结合
,再结合![]() 计算即可。
计算即可。
![]() 为29号元素,最外层为span>4s电子,s原子轨道呈球形;基态
为29号元素,最外层为span>4s电子,s原子轨道呈球形;基态![]() 的价电子轨道表达式为:
的价电子轨道表达式为: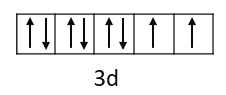 ;
;
![]() 的2p轨道为半充满结构,故N的第一电离能比C和O大,Cu为金属,第一电离能最小,故第一电离能:
的2p轨道为半充满结构,故N的第一电离能比C和O大,Cu为金属,第一电离能最小,故第一电离能:![]() ;该氨基酸铜中含有双键的碳原子杂化方式为
;该氨基酸铜中含有双键的碳原子杂化方式为![]() ,以单键连接其它原子的杂化方式为
,以单键连接其它原子的杂化方式为![]() ;
;![]() 中有一个
中有一个![]() 键,故1mol氨基酸铜含有
键,故1mol氨基酸铜含有![]() 键;
键;
![]() 中N的杂化轨道数
中N的杂化轨道数![]() ,采用
,采用![]() 杂化,空间构型为正四面体形;
杂化,空间构型为正四面体形;![]() 与
与![]() 原子总数相同,价电子总数相同,互为等电子体;
原子总数相同,价电子总数相同,互为等电子体;
![]() 铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足
铜晶体为面心立方结构,设Cu的原子半径为r,则边长a与半径r满足![]() ,求得
,求得![]() ,所以空间利用率
,所以空间利用率 ,每个铜原子距离最近的铜原子数为12,配位数为12;
,每个铜原子距离最近的铜原子数为12,配位数为12;
![]() 每个晶胞含有Cu:
每个晶胞含有Cu:![]() ,含有N:
,含有N:![]() ,故晶体的化学式为
,故晶体的化学式为![]() ,每个晶胞的质量
,每个晶胞的质量![]() ,晶胞的体积
,晶胞的体积![]() ,故晶胞的密度
,故晶胞的密度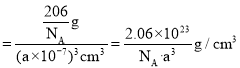 。
。

 名校课堂系列答案
名校课堂系列答案【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
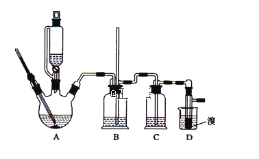
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
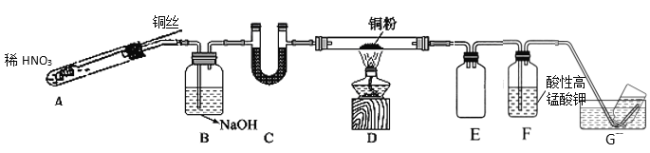
①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
【题目】无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃。化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH![]() CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。
CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。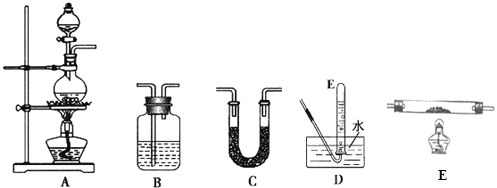
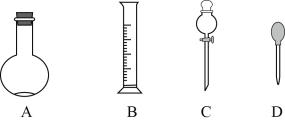
(1)请从图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置。现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水。将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写)。___
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
D | -- |
证明有一氧化碳生成的现象是___。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)24H2O]晶体。查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇。
相关的化学方程式是:2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O;Cu(OH)2CuCO3+4HCOOH+5H2O=2Cu(HCOO)24H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
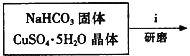
![]()
![]()
①步骤ⅰ是将一定量CuSO45H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的![]() 时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
③制取甲酸铜时需要趁热过滤的原因是___。
④用无水乙醇洗涤晶体的目的是___