题目内容
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物,单质X、Y是生活中常见的金属,试剂1和试剂2分别为常见的酸或碱.相关物质间的转化关系如下图所示(部分反应物与产物已略去):
请回答:
(1)①组成单质X的元素原子结构示意图是______;
②组成单质Y的元素在周期表中的位置______.
(2)若试剂1为强碱溶液,则X与试剂1反应的离子方程式是______.
(3)①若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是______.
②将物质C溶于水,其溶液呈______(填“酸性”、“中性”或“碱性”),原因用离子方程式可表示为______.
(4)若试剂2为稀硫酸,工业上以E、稀硫酸和NaNO2为原料制备高效净水剂Y(OH)SO4,且反应中有NO生成,写出该反应的化学方程式______.
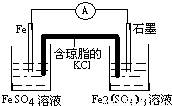
(5)请将D+Y→E的过程设计成一个能产生持续而稳定电流的原电池装置(使用盐桥),在框格内画出实验装置图,并在图中标出电极和试剂的名称.
【答案】分析:(1)A、B是氧化物,单质X、Y是生活中常见的金属,则该反应是铝热反应,X的铝,Y是铁,A是氧化铁,B是氧化铝,根据原子核外电子画出X原子结构示意图判断Y在周期表中的位置;
(2)若试剂1为强碱,铝和强碱反应生成偏铝酸盐和氢气;
(3)①若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A是氧化铁;
②根据盐的类型确定其溶液的酸碱性;
(4)根据反应物、生成物写出反应方程式;
(5)失电子的金属作负极,不如负极材料活泼的金属或导电的非金属作正极,负极上失电子,正极上得电子,据此设计原电池.
解答:解:(1)①A、B是氧化物,单质X、Y是生活中常见的金属,则该反应是铝热反应,X的铝,Y是铁,A是氧化铁,B是氧化铝,X原子核外有13个电子,根据电子排布规律知,其原子结构示意图为: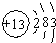 ;
;
故答案为: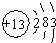 ;
;
②Y是26号元素,该原子核外有4个电子层,最外层有2个电子,位于第四周期第VIII族,
故答案为:第四周期第 VIII族;
(2)若试剂1为强碱溶液,铝和强碱溶液反应生成偏铝酸盐和氢气,其离子反应方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)①若试剂1和试剂2相同,则试剂为酸溶液,且E溶液加热蒸干并灼烧后可得到A,则该酸必须是盐酸,加热氯化亚铁溶液,氯化亚铁和氧气反应生成氯化铁,氯化铁水解生成氢氧化铁,灼烧氢氧化铁得到氧化铁,则A的化学式是Fe2O3,故答案为:Fe2O3;
②氯化铝是强酸弱碱盐,铝离子水解导致溶液中氢离子浓度大于氢氧根离子浓度,所以其溶液呈酸性,
故答案为:酸性,Al3++3H2O?Al(OH)3+3H+;
(4)若试剂2为稀硫酸,E是硫酸亚铁,工业上以硫酸亚铁、稀硫酸和NaNO2为原料制备高效净水剂Fe(OH)SO4,且反应中有NO生成,则亚铁离子被氧化生成铁离子,所以其反应方程式为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑,故答案为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑;
(5)D中含有铁离子,Y是Fe,E中含有亚铁离子,将D+Y→E的过程设计成一个能产生持续而稳定电流的原电池装置(使用盐桥),则必须是铁作负极,且负极的电解质溶液是硫酸亚铁溶液,可以选石墨作正极,正极的电解质溶液是硫酸铁溶液,所以其装置图为:
 ,故答案为:
,故答案为: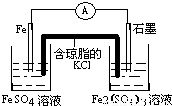 .
.
点评:本题考查元素化合物的推断及物质的性质,正确推断元素是解本题关键,原电池的设计是学习难点,根据原电池原理来设计即可,难度中等.
(2)若试剂1为强碱,铝和强碱反应生成偏铝酸盐和氢气;
(3)①若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A是氧化铁;
②根据盐的类型确定其溶液的酸碱性;
(4)根据反应物、生成物写出反应方程式;
(5)失电子的金属作负极,不如负极材料活泼的金属或导电的非金属作正极,负极上失电子,正极上得电子,据此设计原电池.
解答:解:(1)①A、B是氧化物,单质X、Y是生活中常见的金属,则该反应是铝热反应,X的铝,Y是铁,A是氧化铁,B是氧化铝,X原子核外有13个电子,根据电子排布规律知,其原子结构示意图为:
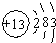 ;
;故答案为:
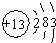 ;
;②Y是26号元素,该原子核外有4个电子层,最外层有2个电子,位于第四周期第VIII族,
故答案为:第四周期第 VIII族;
(2)若试剂1为强碱溶液,铝和强碱溶液反应生成偏铝酸盐和氢气,其离子反应方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)①若试剂1和试剂2相同,则试剂为酸溶液,且E溶液加热蒸干并灼烧后可得到A,则该酸必须是盐酸,加热氯化亚铁溶液,氯化亚铁和氧气反应生成氯化铁,氯化铁水解生成氢氧化铁,灼烧氢氧化铁得到氧化铁,则A的化学式是Fe2O3,故答案为:Fe2O3;
②氯化铝是强酸弱碱盐,铝离子水解导致溶液中氢离子浓度大于氢氧根离子浓度,所以其溶液呈酸性,
故答案为:酸性,Al3++3H2O?Al(OH)3+3H+;
(4)若试剂2为稀硫酸,E是硫酸亚铁,工业上以硫酸亚铁、稀硫酸和NaNO2为原料制备高效净水剂Fe(OH)SO4,且反应中有NO生成,则亚铁离子被氧化生成铁离子,所以其反应方程式为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑,故答案为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑;
(5)D中含有铁离子,Y是Fe,E中含有亚铁离子,将D+Y→E的过程设计成一个能产生持续而稳定电流的原电池装置(使用盐桥),则必须是铁作负极,且负极的电解质溶液是硫酸亚铁溶液,可以选石墨作正极,正极的电解质溶液是硫酸铁溶液,所以其装置图为:
 ,故答案为:
,故答案为: .
.点评:本题考查元素化合物的推断及物质的性质,正确推断元素是解本题关键,原电池的设计是学习难点,根据原电池原理来设计即可,难度中等.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
