题目内容
(1)0.7 mol H2O的质量为____________,其中含有_________个水分子,氢原子的物质的量为__________。
(2)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(3)在_______mL 0.2 mo1·L-1 NaOH溶液(密度为1 g·cm-3)中含1g溶质;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O__________g。
(1)12.6g,4.214×1023 ,1.4mol (2)SO2 ,H2 (3)125 2.5
【解析】
试题分析:(1)水的摩尔质量是18g/mol,所以0.7 mol H2O的质量为0.7mol×18g/mol=12.6g;其中含有0.7mol×6.02×1023 /mol=4.214×1023 个水分子,氢原子的物质的量为0.7mol×2=1.4mol。
(2)根据阿伏加德罗定律可知,气体的物质的量越多,含有的分子数越多。根据n=m/M可知,在气体的质量相等的条件下,气体的相对分子质量越大,气体的物质的量越小,则质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是SO2。氢气的相对分子质量最小,则在相同温度和相同压强和质量相等的条件下体积最大的是氢气。
(3)1g氢氧化钠的物质的量是 ,因此需要0.2 mo1·L-1 NaOH溶液的体积是
,因此需要0.2 mo1·L-1 NaOH溶液的体积是 ÷0.2mol/L=0.125L=125ml。配制50mL0.2 mo1·L-1
CuSO4溶液,需要CuSO4·5H2O的质量是0.05L×0.2mol/L×250g/mol=2.5g。
÷0.2mol/L=0.125L=125ml。配制50mL0.2 mo1·L-1
CuSO4溶液,需要CuSO4·5H2O的质量是0.05L×0.2mol/L×250g/mol=2.5g。
考点:考查物质的量的有关计算
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。在进行物质的量的有关计算时,关键是熟练应用几个关系式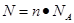 、n=m/M、
、n=m/M、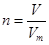 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。

 名校课堂系列答案
名校课堂系列答案