题目内容
【题目】把在空气中久置的镁条7.2 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
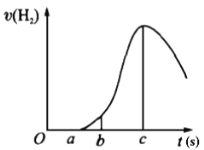
(1)曲线由0→a段不产生氢气的原因________,有关的离子方程式为______________;
(2)曲线由b→c段,产生氢气的速率逐渐增大的主要原因________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因________________。
(4)在b到c这段时间内,收集到氢气V L(标准状况),则这段时间内用硫酸表示的平均速率为________mol/(L·s)(假设反应前后溶液体积不变)。
(5)对于足量镁条和100 mL 2 mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是________。
①加NaOH固体;②加BaCl2溶液;③加KNO3溶液;④加H2O;⑤加CH3COONa固体;⑥加小苏打溶液;⑦加少量CuSO4溶液;⑧加Na2SO4溶液;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸;⑩将镁条换成镁粉。
【答案】镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气 MgO+2H+=Mg2++H2O 镁和硫酸反应放出的热量使溶液温度升高而加快反应速率 随着反应的进行,硫酸的浓度逐渐变小,该因素变为影响反应速率的主要因素,使反应速率减小 ![]() ②④⑤⑧⑨
②④⑤⑧⑨
【解析】
(1)根据镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气进行分析;
(2) (3)根据反应过程中有硫酸的浓度变化和反应体系的温度变化分析;
(4)根据氢气的生成量计算硫酸的消耗量,从而计算速率。
(5)根据过程中氢离子的浓度和氢离子的物质的量的变化进行分析,注意原电池等影响。
(1)镁条表面有氧化镁,硫酸首先和与表面的氧化镁反应,不产生氢气,所以开始没有气体产生,反应的离子方程式为:MgO+2H+=Mg2++H2O;
(2) 随着反应的进行,硫酸的浓度减小,反应放热,温度升高,b→c段反应速率加快,说明是镁和硫酸反应放出的热量使溶液温度升高而加快反应速率;
(3) 随着反应的进行,硫酸的浓度逐渐变小,反应放热,温度升高,c后反应速率减慢,说明该阶段浓度为影响反应速率的主要因素,使反应速率减小;
(4) 在b→c段时间内,收集到氢气V L(标准状况),即氢气的物质的量为![]() mol,则硫酸的消耗的物质的量为
mol,则硫酸的消耗的物质的量为![]() mol,浓度改变量为
mol,浓度改变量为![]() mol/L,反应速率为
mol/L,反应速率为 ![]() mol/(L·min);
mol/(L·min);
(5) ①加NaOH固体消耗硫酸,H+物质的量和浓度都减小,反应速率减慢,产生氢气的量减小;②加BaCl2溶液,反应生成硫酸钡沉淀和盐酸,溶液的体积变大,氢离子浓度减小,速率减慢,不影响氢气的量;③加KNO3溶液,NO3-酸性条件下具有强氧化性,与镁反应不产生氢气;④加H2O,硫酸浓度减小,速率减慢,不影响氢气的量;⑤加CH3COONa固体,与硫酸反应生成醋酸,氢离子浓度减小,速率减慢,不影响氢气的量;⑥加小苏打溶液,与硫酸反应生成硫酸钠、水和二氧化碳,H+物质的量和浓度都减小,反应速率减慢,产生氢气的量减小;⑦加少量CuSO4溶液,镁和硫酸铜反应生成铜,形成原电池,反应速率加快;⑧加Na2SO4溶液,硫酸浓度减小,速率减慢,不影响氢气的量;⑨将2 mol/L硫酸换成160 mL 2.5 mol/L的盐酸,氢离子浓度减小,但氢离子总量不变,速率减慢,不影响氢气的总量;⑩将镁条换成镁粉,反应速率加快。故速率减慢不影响氢气的量的为:②④⑤⑧⑨。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案