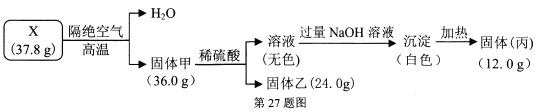
题目内容
【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
(1)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)
A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
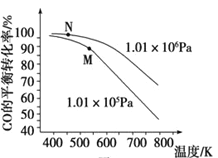
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。
【答案】2 Cu-2e-+2OH-=Cu2O+H2O 4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol或者【△H=(4b+c-a kJ/mol)】 CD 0.12 mol/(L·min) 9.375 增大 相对于 N 点而言,采用 M 点,温度在 500~600 K 之间,温度较高,反应速率较快,CO 的平衡转化率也较高,压强为常压,对设备要求不高
【解析】
(1)工业上用铜作阳极,钛片为阴极,电解法电解一定浓度的NaOH 溶液可制备氧化亚铜,则阳极的电极反应式为Cu-2e-+2OH-=Cu2O+H2O:答案:Cu-2e-+2OH-=Cu2O+H2O。
(2)①将题中所给反应方程式依次编号:(1)N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol;(2)Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol;(3)4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol;由盖斯定律4![]() (2)+(3)-(1)有:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +(4b+c-a) kJ/mol 答案:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol。
(2)+(3)-(1)有:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +(4b+c-a) kJ/mol 答案:4 Cu(OH)2(s)+N2H4(l)=2Cu2O(s)+N2(g)+6H2O(l)△H= +4b+c-a kJ/mol。
Ⅱ.(1) A.由CO(g)+2H2(g)![]() CH3OH(g) △H = -90.8 kJ/mol,知当反应的热效应△H = -90.8 kJ/mol 时,不能确定反应否达到平衡状态,故A错误;B.混合气体总质量不变,容器容积恒定,容器内混合气体的密度始终保持不变,故B错误;C.在绝热恒容的容器中,随反应进行温度发生变化,平衡常数也随之发生变化,当反应的平衡常数不再变化时说明反应到达平衡,故C正确的;D.混合气体总质量不变,随反应进行混合气体总物质的量增大,则气体的平均摩尔质量进行,当气体的平均摩尔质量不再变化时,说明反应到达平衡,故D正确;答案:CD正确的;
CH3OH(g) △H = -90.8 kJ/mol,知当反应的热效应△H = -90.8 kJ/mol 时,不能确定反应否达到平衡状态,故A错误;B.混合气体总质量不变,容器容积恒定,容器内混合气体的密度始终保持不变,故B错误;C.在绝热恒容的容器中,随反应进行温度发生变化,平衡常数也随之发生变化,当反应的平衡常数不再变化时说明反应到达平衡,故C正确的;D.混合气体总质量不变,随反应进行混合气体总物质的量增大,则气体的平均摩尔质量进行,当气体的平均摩尔质量不再变化时,说明反应到达平衡,故D正确;答案:CD正确的;
(2)① H2和CO总共为3mol,且起始n(H2)/n(CO)= 2,可以知道H2为2mol、CO为1mol, 5min 达到平衡时CO的转化率为0.6,则:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol)12 0
变化(mol)0.6 1.2 0.6
平衡(mol)0.4 0.8 0.6
容器的容积为2L,则v (H2)= (1.2mol![]() )/5min=0.12 mol/(L·min);该温度下平衡常数K= c(CH3OH)/c(CO)
)/5min=0.12 mol/(L·min);该温度下平衡常数K= c(CH3OH)/c(CO)![]() c(H2)=(0.6
c(H2)=(0.6![]() /( 0.4
/( 0.4![]() 0.8
0.8![]() 2=9.375。此时再向容器中加入CO(g) 和CH3OH(g) 各0.4mol,此时浓度商 Qc=[(0.6+0.4)
2=9.375。此时再向容器中加入CO(g) 和CH3OH(g) 各0.4mol,此时浓度商 Qc=[(0.6+0.4)![]() /[(0.4+0.4)
/[(0.4+0.4)![]() 2]
2]![]() 0.8
0.8![]() 2=7.813<9.375,所以反应向正反应进行,达新平衡时H2的转化率将增大。因此答案是: 0.12 mol/(L·min) ; 9.375;增大。
2=7.813<9.375,所以反应向正反应进行,达新平衡时H2的转化率将增大。因此答案是: 0.12 mol/(L·min) ; 9.375;增大。
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件是:相对于N点而言,采用M点,温度在500~600 K之间,温度较高,反应速率较快, CO的平衡转化率也较高,压强为常压,对设备要求不高。答案:相对于 N 点而言,采用 M 点,温度在 500~600 K 之间,温度较高,反应速率较快,CO 的平衡转化率也较高,压强为常压,对设备要求不高。