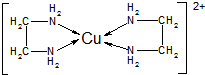
题目内容
3.SO2是一种大气污染物,排放前需要进行处理.(1)SO2可以形成硫酸型酸雨SO2+H2O=H2SO3 ,反应的化学方程式是2H2SO3+O2=2H2SO4.
(2)用NaOH溶液可以吸收SO2,反应的离子方程式是2OH-+SO2═SO32-+H2O.
(3)向煤中加入石灰石,燃烧中SO2可转化为CaSO4,该反应的化学方程式是2CaCO3+2SO2+O2=2CaSO4+2CO2.
分析 (1)二氧化硫与水反应生成亚硫酸,亚硫酸具有还原性被空气中的氧气氧化生成硫酸;
(2)二氧化硫与过量的氢氧化钠反应生成亚硫酸钠和水;
(3)碳酸钙和氧气和二氧化硫反应生成硫酸钙和水,根据反应物与生成物来书写化学反应方程式.
解答 解:(1)SO2、O2形成硫酸型酸雨的反应:SO2+H2O=H2SO3; 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
故答案为:SO2+H2O=H2SO3; 2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
(2)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(3)向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,发生的化学反应为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,
故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.
点评 本题考查了二氧化硫的性质,明确二氧化硫为酸性氧化物,具有还原性是解题关键,题目较简单.

练习册系列答案
相关题目
3.某烯烃加氢后产物的结构简式为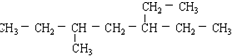 ,此烯烃可能的结构有( )
,此烯烃可能的结构有( )
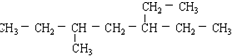 ,此烯烃可能的结构有( )
,此烯烃可能的结构有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
4.物质的鉴别有很多种方法,下列能达到鉴别目的是( )
①用水鉴别苯、乙醇、溴苯;
②用饱和的Na2CO3溶液鉴别乙酸、乙酸乙酯和CCl4;
③用酸性高锰酸钾鉴别正戊烷、己烯和乙醇;
④用点燃的方法鉴别甲烷、乙烯和乙炔(C2H2).
①用水鉴别苯、乙醇、溴苯;
②用饱和的Na2CO3溶液鉴别乙酸、乙酸乙酯和CCl4;
③用酸性高锰酸钾鉴别正戊烷、己烯和乙醇;
④用点燃的方法鉴别甲烷、乙烯和乙炔(C2H2).
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
18.下列有关碱金属铷(Rb)的叙述中,错误的是( )
| A. | 灼烧硝酸铷时,火焰有特殊颜色 | |
| B. | 氯化铷是离子化合物 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
8.下列有关说法不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 聚氯乙烯塑料强度大,抗腐蚀性强,可以用来包装需长时间保存的食品 | |
| C. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| D. | 用于食品包装的塑料制品,属于热塑性塑料,可回收再利用 |
13.下列各组离子能在指定溶液中大量共存的是( )
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+、SO32ˉ、S2ˉ、SO42ˉ | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Clˉ、CO32ˉ、NH4+、NO3ˉ | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3ˉ | |
| D. | pH=2的溶液中:Na+、SO42ˉ、NO3ˉ、AlO2ˉ |
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.