题目内容
11. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)X2M的燃烧热△H=-a kJ•mol-1,写出X2M燃烧热的热化学方程式:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l),△H=-2aKJ•mol-1.
(4)ZX的电子式为
 ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
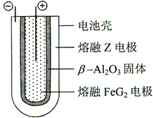
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+FeG2$?_{充电}^{放电}$Fe+2ZG
放电时,电池的正极反应式为:Fe2++2e-=Fe,充电时,钠(写物质名称)电极接电源的负极;该电池的电解质为β-Al2O3.
分析 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),据此解答.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),
(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,
非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,
故答案为:HClO4;H2S;
(3)H2S的燃烧热△H=-a kJ•mol-1,根据燃烧热的含义,H2S燃烧的热化学方程式生成物应该生成SO2,故H2S燃烧反应的热化学方程式为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l),△H=-2aKJ•mol-1,
故答案为:2H2S(g)+3O2(g)=2 SO2(g)+2H2O(l),△H=-2aKJ•mol-1;
(4)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为  ,Na与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,
,Na与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,
故答案为: ;NaH+H2O=NaOH+H2↑.
;NaH+H2O=NaOH+H2↑.
(5)熔融状态下,Na和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2$?_{充电}^{放电}$Fe+2NaCl,放电时,FeCl2是氧化剂,在电池的正极发生还原反应,反应式为:Fe2++2e-=Fe,Na是还原剂,在负极发生氧化反应,所以充电时,钠电极接电源的负极,根据题中图示可知,该电池的电解质为β-Al2O3,
故答案为:Fe2++2e-=Fe;钠;β-Al2O3.
点评 本题以元素推断为载体考查了元素化合物的性质,能正确判断元素是解本题的关键,注意(4)中NaH电子式书写氢负离子的电子式2个电子成对,不能分开.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 电离时能生成H+的化合物一定是酸 | |
| B. | 碱在电离时一定有OH-生成 | |
| C. | 因为硫酸由H+和SO42-构成,故电离时能生成H+和SO42- | |
| D. | 氢氧化钠在水溶液中和熔化时都能发生电离 |
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-═Cu2+ |
| A. | 放电时,电流由Pb流向PbO2 | B. | 放电时,Pb发生氧化反应 | ||
| C. | 充电时,在阴极区pH下降 | D. | 充电时,在阳极上PbSO4转化为Pb |
 丙泊酚,其化学名为2,6-双异丙基苯酚,是目前临床上普遍用于麻醉诱导、麻醉
丙泊酚,其化学名为2,6-双异丙基苯酚,是目前临床上普遍用于麻醉诱导、麻醉维持、ICU危重病人镇静的一种新型快速、短效静脉麻醉药.其结构如图:关于丙泊酚,下列说法正确的是( )
| A. | 分子式为C10H20O | |
| B. | 分子中所有碳原子可能在同一平面中 | |
| C. | 该物质的1H核磁共振谱图中有5个特征峰,峰值强度比大概为:1:1:2:2:12 | |
| D. | 该物质结构中有2个手性碳原子 |

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 1 mol该化合物最多可以与3 mol NaOH反应 |