题目内容
【题目】在5L Na2SO4溶液中含有Na+离子4.6g,则溶液中SO42-离子的物质的量浓度为( )
A. 0.2mol·L-1 B. 0.04 mol·L-1 C. 0.08 mol·L-1 D. 0.02mol·L-1
【答案】D
【解析】Na+离子4.6g,则钠离子的物质的量是4.6g÷23g/mol=0.2mol,根据化学式可知溶液中SO42-离子的物质的量是0.2mol÷2=0.1mol,因此硫酸根的物质的量浓度为0.1mol÷5L=0.02mol/L,答案选D。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第周期,第族;
(2)X可形成双原子分子,其分子的电子式是;Y和氢元素形成的10电子微粒中常见的+1价阳离子为(填化学式,下同);Z和氢元素形成的18电子微粒中常见的﹣1价阴离子为;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是 .
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如下: 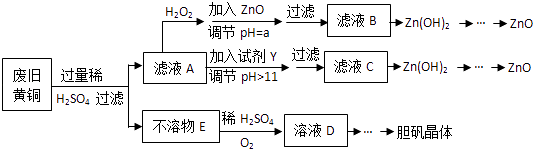
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 , a的范围是 .
(2)由不溶物E生成溶液D的化学方程式为 .
(3)滤液A中加入H2O2反应的离子方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 . A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .