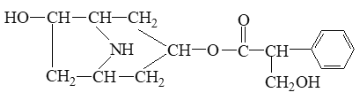
题目内容
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【答案】C
【解析】
A.CO的物质的量的变化为(2.00-0.80)mol,反应在t1min内的平均速率为v(CO)=(2.00-0.80)mol ÷2L÷t1min =(0.60/t1)mol·L-1·min-1,根据反应速率之比等于化学计量数之比,t1min内H2的平均反应速率与CO的平均反应速率相同,故A正确;
B.根据t2>t1,对比表中数据可知t1 min时已经达到平衡状态,而反应物和生成物的化学计量数都为1,则其它条件不变,起始时向容器中充入的3.00 molCO和2.00 molH2O(g)与充入2.00molCO和3.00molH2O(g)达平衡时,反应的限度相同,故达到平衡时,n(CO2)=1.20 mol,故B正确;
C.增大反应物CO的浓度,平衡正向移动,CO转化率减小,水蒸气的转化率增大,故C错误;
D.T1℃时,该反应的平衡常数为K=(1.2/2)×(1.20/2)÷(0.80/2)×(1.80/2)=1,T2℃,上述反应的平衡常数为0.70,温度升高,平衡常数减小,平衡逆向移动,说明正反应为放热反应,故D正确。
故选C。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
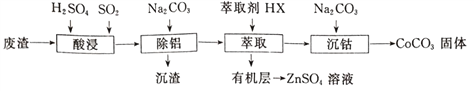
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105