题目内容
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
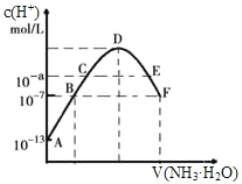
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
【答案】酸性 E>D>A = A D NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的沉淀溶解平衡正向移动 猜想1
【解析】
(1) ①未加入氨水前,溶液的水电离出的OH-浓度为10-13mol/L,所以溶液中c(H+)=0.1mol/L,该酸的浓度为0.05mol/L,所以该酸为二元强酸;
②酸、碱对水的电离起抑制作用,可水解的盐对水的电离起促进作用,随着氨水的不断滴入,溶液中水电离的c(H+)逐渐增大,当两者恰好完全反应生成(NH4)2B时水的电离程度达最大(图中D点),继续加入氨水,水电离的c(H+)逐渐减小;
③溶液中的电荷守恒,可得到答案;
(2)(3)根据已知数据,求出两种物质的物质的量,可确定反应是否完全,再结合Ksp的大小,可判断出沉淀转化的本质,是由Ksp的大小引起的,还是发生其它反应生成的;沉淀的溶解要根据物质的性质来确定,Mg(OH)2属于弱碱,能够与NH4+水解生成的H+发生中和反应而溶解,也能够与NH4+发生复分解反应,生成弱电解质NH3·H2O而溶解,要验证溶解的原因,可用含NH4+的中性溶液做对比实验。
(1) ①NaHB属于强酸的酸式盐,NaHB溶液应该呈酸性,故答案为:酸性;
②向酸溶液中逐渐加入碱发生中和反应,混合液溶液的pH是逐渐增大的,而A显酸性,最小,pH由大到小为E>D>A,故答案为E>D>A;
③D.F点溶液由(NH4)2B和氨水混合而成,由于水电离的c(H+)=1×10-7mol/L,溶液中H+全部来自水电离,则F点水溶液呈中性,此时溶液中的电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(B2-),因c(H+)=c(OH-),所以有c(NH4+)=2c(B2-),故答案为:=;
(2) ①已知n(MgCl2)=1×10-3L×0.1mol/L=1×10-4mol,n(NaOH)≈0.1×10-3L×2mol/L=2×10-4mol,由反应Mg2++2OH-=Mg(OH)2↓可知,二者基本反应完全,生成白色沉淀Mg(OH)2,当向其中加入FeCl3溶液时,由于Ksp[Fe(OH)3]=4.0×10-38远小于Ksp[Mg(OH)2]=1.8×10-11,所以白色沉淀Mg(OH)2转化为红褐色沉淀Fe(OH)3,故答案选A;当向其中加入NH4Cl溶液,NH4+与Mg(OH)2电离出的OH-结合生成弱电解质NH3·H2O,使Mg(OH)2的溶解平衡正向移动,最终使Mg(OH)2完全溶解得无色溶液,所以答案选D;
②NH4Cl因水解而呈酸性,生成的H+与Mg(OH)2电离出OH-结合生成水,使Mg(OH)2的溶解平衡正向移动,故答案为:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的沉淀溶解平衡正向移动;
(3)由于醋酸铵溶液(pH=7)呈中性,能使Mg(OH)2沉淀溶解,说明不是NH4+水解呈酸性导致Mg(OH)2溶解;当加入弱碱性的NH4Cl和氨水混合液(pH=8)时,沉淀也溶解,说明猜想2是错误的。因此证明Mg(OH)2沉淀溶解的根本原因是NH4+与Mg(OH)2电离出OH-结合生成弱电解质NH3·H2O,促进Mg(OH)2溶解平衡正向移动,最终得无色溶液,所以猜想1是正确的,故答案为:猜想1。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】用如图所示装置检验对应气体时,不能达到目的是

(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D